
题目列表(包括答案和解析)
3.下列有机物中, 既能使溴水褪色, 又能使酸性KMnO4溶液褪色, 还能与新制Cu(OH)2悬浊液发生反应的是 ( )
A.1,3-二烯 B.苯酚 C.对二甲苯 D.丙烯醛
2.居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料会释放出一种刺激性气味气体,该气体是 ( )
A.甲烷 B.氨气 C.甲醛 D.二氧化硫
1. 一定量的某饱和一元醛发生银镜反应,析出银21.6g,等量的此醛完全燃烧时生成CO2 8.96L(标况) ,则此醛是( )
A. 乙醛 B. 丙醛
C. 丁醛 D. 2-甲基丙醛
0.1000mol/LNaOH标准溶液;
100mL容量瓶,10ml移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊)。
[实验步骤]
① 配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中。
② 盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
③ 滴定
往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2-3滴,滴定至终点。记录NaOH的终读数。重复滴定3次。
[数据记录]
|
滴定次数 实验数据 |
1 |
2 |
3 |
4 |
|
V(样品)/mL |
20.00 |
20.00 |
20.00 |
20.00 |
|
V (NaOH)始/mL |
0.00 |
0.20 |
0.10 |
0.10 |
|
V (NaOH)终/mL |
14.98 |
15.20 |
15.12 |
16.24 |
[问题与思考]
⑴ 步骤①中中还需补充的仪器有 ▲ 。蒸馏水的处理方法是 ▲ 。
⑵ 步骤③中你选择的酸碱指示剂是 ▲ ,理由是 ▲ 。
⑶ 若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是 ▲ 。
⑷ 样品总酸量= ▲ g/100mL。
下列A、B两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
21.(12分)
A.分子式为Pt(NH3)2Cl2的配位化合物有顺铂和反铂两种同分异构体。顺铂的结构式为 ,具有抗癌作用;反铂的结构式为
,具有抗癌作用;反铂的结构式为 ,无抗癌作用。
,无抗癌作用。
⑴ C、N、O三种元素的电负性由大到小的顺序是 ▲ ;Ni元素与Pt元素位于同一族,写出Ni元素基态原子的电子排布式: ▲ 。
⑵ 顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由: ▲ 。
⑶ 金属铂的原子堆积方式为与铜型(面心立方堆积),一个金属铂的晶胞中含有 ▲ 个铂原子。
⑷ NH3还能与很多化合物通过配位键发生相互作用。例如:科学家潜心研究的一种可作储氢材料的化合物 X是NH3与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体;加热化合物 X会缓慢释放H2,转变为化合物Y,Y是乙烯的等电子体。
① 化合物X的结构式为 ▲ (必须标明配位键)。
② 化合物X、Y分子中,N元素分别发生了 ▲ 杂化。
B.某化学研究性学习小组拟测定食醋的总酸量(g/100mL),请你参与该小组的实验并回答相关问题。
[实验目的]测定食醋的总酸量
[实验原理]中和滴定
[实验用品]蒸馏水,市售食用白醋样品500mL(商标注明总酸量:3.50g/100mL-5.00g /100mL),
20.(10分)现代化学工业遵循可持续发展原则,利用淀粉、纤维素等可再生资源合成多种化工产品。
⑴ 以淀粉为原料可制取香料乙酸乙酯,生产流程为:

 ① 部分链状葡萄糖分子在水溶液中通过分子内加成反应,以六元环或五元环的形式存在,其中六元环
① 部分链状葡萄糖分子在水溶液中通过分子内加成反应,以六元环或五元环的形式存在,其中六元环
的结构为 ,则葡萄糖在水溶液存在的五元环结构为 ▲ 。
② 若用1000 kg 含(C6H10O5)n 90%的淀粉(杂质不参与反应)为原料制取乙酸乙酯。生产中,淀粉的水解率为90%,乙醇的产率为85%,酯化反应中乙醇、乙酸的转化率均为90%。计算生产中得到的乙酸乙酯的质量(kg)。
⑵ 纤维素的结构可表示为[(C6H7O2)(OH)3]n。10.00 g脱脂棉花(纤维素含量为100%)与乙酸、乙酸酐[(CH3CO)2O]的混合物在一定条件下发生酯化反应,可制得15.19 g醋酸纤维 (纤维素乙酸酯)。请通过计算推断该醋酸纤维的结构简式。
19.(12分)氯普鲁卡因盐酸盐是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,以甲苯为初始原料的合成氯普鲁卡因盐酸盐的路线如下:

回答下列问题:
⑴ 当原料的核磁共振氢谱有 ▲ 个峰时,可以判断原料是纯净的。
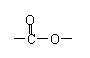 ⑵ B的结构简式是 ▲ ,反应②的类型是 ▲ 。
⑵ B的结构简式是 ▲ ,反应②的类型是 ▲ 。
⑶ A的同分异构体中,含有-NO2、-Cl、酯基( ),且为1,3,5-三取代苯结构的有6种,其中4种结构如下:
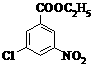



请写出另外两种同分异构体的结构简式: ▲ 。
⑷ 已知:
①
② 当苯环上已有一个“-CH3”或“-Cl”时,新引入的取代基一般在原有取代基的邻位或对位;当苯环上已有一个“-NO2”或“-COOH”时,新引入的取代基一般在原有取代基的间位。
请用合成反应流程图表示出由甲苯和其他物质合成A的最佳方案,请在答题纸的方框中表示。
合成反应流程图表示方法示例如下:

18.(10分)钛在地壳中的含量比铜多61倍,排第十位。钛及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域。
⑴ 由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):

上述熔炼过程发生的反应为吸热反应,该反应能够自发进行的原因是 ▲ ;还原过程必须在1070K的温度下进行,你认为还应该控制的反应条件是 ▲ 。
⑵ 用浓硫酸处理钛铁矿,并向所得溶液中加入铁,此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
|
氢氧化物 |
Fe(OH)2 |
TiO(OH)2 |
Mg(OH)2 |
|
Ksp |
8.0×10-16 |
1.0×10-29 |
1.8×10-11 |
常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于 ▲ 时,Mg(OH)2开始沉淀。
 若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
白色沉淀,写出该反应的离子方程式: ▲ 。
⑶ BaTiO3是一种可用来吸收低频波的无机功能材料。工业上,常用
BaCl2、TiCl4、H2O和H2C2O4混合反应生成白色固体A,将该白色
固体加热分解至900K可得BaTiO3,实验测得其热分解过程的质量
-温度关系曲线如右图所示,图中400K、600K和900K时对应的
样品的质量分别为8.38mg、5.68mg和5.19mg。白色固体A的化学式
为 ▲ (填序号)。
a.BaTi2O5 b.BaC2O4·2H2O c.BaTi(C2O4)3 d.BaTiO (C2O4)2·4H2O
17.(10分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
① CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
② CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH2=+247.3
kJ/mol
2CO(g)+2H2(g) ΔH2=+247.3
kJ/mol
③ CO(g)+H2O(g) CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
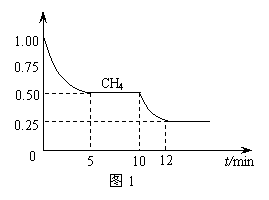
⑴ 在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示。反应进行的前5 min内, v(H2)= ▲ ;10 min时,改变的外界条件可能是 ▲ 。


⑵ 如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。


⑶ 反应③中ΔH3= ▲ 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
|
CO |
H2O |
CO2 |
H2 |
|
0.5 mol |
8.5 mol |
2.0 mol |
2.0 mol |
此时反应③中正、逆反应速率的关系式是 ▲ (填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
16.(8分)下列框图涉及到的物质所含元素中,除一种元素外,其余均为1-18号元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列全)。

请回答下列问题:
⑴ G的化学式为 ▲ 。
⑵ 写出B与C反应的化学方程式 ▲ 。
⑶ J、K是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式 ▲ 。
⑷ 汽车尾气中常含有D。B与D在加热和催化剂存在的条件下,发生反应生成两种对空气无污染的物质。请写出该反应的化学方程式 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com