
题目列表(包括答案和解析)
2.根据下列反应判断有关物质还原性由强到弱的顺序是
①H2SO3 + I2 + H2O = 2HI + H2SO4
②2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
③3FeCl2 + 4HNO3 = 2FeCl3 + NO↑ + 2H2O + Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO3>NO D.NO>Fe2+>H2SO3>I-
1.在3S + 6KOH = 2K2S + K2SO3 + 3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是
A.1∶2 B.2∶1 C.1∶3 D.3∶1
6. 某同学取一张铝箔,并用针刺一些小孔,然后取一药匙过氧化钠粉末,用铝箔包好,放入下图所示装置倒扣的漏斗中。
 (1)按顺序写出该过程中发生反应的离子方程式:
(1)按顺序写出该过程中发生反应的离子方程式:
①
② ;
(2)反应结束后,用拇指堵住试管口后将试管移出,
靠近燃着的酒精灯,松开手指,观察到的现象
是 。
5.用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得到的有过氧化钠跟水反应的结论是:
第一,为氧气生成,
 第二,
。
第二,
。
Na2O2跟水反应的化学方程式是
。
(2)某研究性学习小组拟用右图所示装置(气密
性良好)进行实验,以证明上述结论。
用以验证第一条结论的实验操作及现象是:
。
用以验证第二条结论的实验操作及现象是:
。
(3)实验(2)向试管中加水至固体完全溶解且不再有气泡生成后,取出度管,向试管中滴入酚酞试液,发现溶液先变红后退色,为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氮化性的漂白性。
请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂: ;
现象: 。
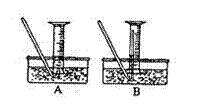 (4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中是否含有H2O2,其实验方法为:称取2.6gNa2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论:
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中是否含有H2O2,其实验方法为:称取2.6gNa2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论:
①测量气体体积时,必须持试管和量筒内的气体
都冷却至室温时进行,应选用如图装置中的
(忽略导管在量筒中所占的体积)
(填序),理由是
。
②若在标准状况下测量气体的体积,应选用的量
筒的大小规格为 (选填“100mL”、“200mL”、“500mL”或“1000mL”)
4. 一定温度下,向饱和NaOH溶液中投入一小块金属钠,充分反应后恢复到原来温度。下列叙述中,不合理的是
A.NaOH溶液浓度增大,并入出H2 B.溶液中NaOH的质量分数不变,有H2放出
C.总溶液的质量减小,有H2放出 D.钠浮于液面,到处游动,发出咝咝的响声
3. 背景材料:①2006年5月信息时报报道:世界卫生组织建议每天钠的摄取量少于2000mg,长期过量摄入钠可能引起高血压肾病胃病;②2007年7月,广西加大人工降雨作业强度,使夏季旱情得以缓解;③空气是人类生存所必需的重大资源改善空气质量称为“蓝天工程”;④2008年夏季奥运会将在我国举行,这次奥运会要突出“绿色奥运 科技奥运 人文奥运”的理念.
下列相应说法不正确的是
A.钠是活泼金属,常常保存在煤油中,人们每天可提取少于2000mg的金属钠
B.AgI和干冰都可用于人工降雨
C.加大石油 煤炭的开采速度,增加化石燃料的供应量不利于“蓝天工程”的建设
D.把环境保护作为奥运设施规划和建设的首要条件之一
2. 在一定条件下,使CO和O2的混合气体26g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的质量比可能是
A.9:4 B.1:1 C.7:6 D.6:7
1. 某溶液含有①NO3- ②HCO3- ③SO32- ④CO32- ⑤SO42-等五种阴离子。向其中加入少量的Na2O2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积的变化)
A.① B.①②④ C.①③⑤ D.①③④⑤
5.在热的稀硫酸溶液中溶解了11.4 g FeSO4。当加入50 mL 0.5 mol / L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。

(1) 推算出x= _________,y= _________
(2) 配平该化学方程式(化学计量数填写在上式方框内)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com