
题目列表(包括答案和解析)
3、2008年北京奥运会主体育场---“鸟巢”使用了高强度的钒氮合金高新钢的884块ETRE膜,并采用了新一代的氮化镓高亮度LED材料。下列有关说法正确的是
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知镓(Ga)处于IIIA族,可推知氮化镓化学式为Ga3N2

 C. ETFE膜( [ CH2-CH2-CF2-CF2
]n)是由两种单体缩聚而成的
C. ETFE膜( [ CH2-CH2-CF2-CF2
]n)是由两种单体缩聚而成的
D.用金属铝与V2O5在高温条件下可以冶炼钒,铝作还原剂
2.下列说法不正确的是
A.研究物质的性质,常用观察、实验、分类、比较等方法;研究物质的结构,常利用模型、假说等方法。
B.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应。
C.硅是将太阳能转化为电能的常用材料
D.先开发资源再治理环境的发展理念符合可持续 发展的基本国策
1. “轻轨电车”是近年新兴的一种交通工具(如图所示)当电车开动时,在电车与架空电线的接触点上,由于高速摩擦会产生高温,因此接触点上的材料应该具有现耐高温,能导电的性质,你认为该接触点上材料的应选用较为合适的是
“轻轨电车”是近年新兴的一种交通工具(如图所示)当电车开动时,在电车与架空电线的接触点上,由于高速摩擦会产生高温,因此接触点上的材料应该具有现耐高温,能导电的性质,你认为该接触点上材料的应选用较为合适的是
A.金刚石 B.铝 C.石墨 D.铜
10.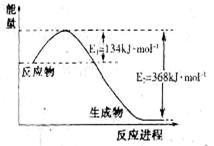 (15分)(1)右图是
(15分)(1)右图是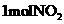 和
和 反应生成
反应生成 和
和 过程中能量变化示意,请写出
过程中能量变化示意,请写出 和
和 反应的热化学方程式_________________________________。
反应的热化学方程式_________________________________。
(2)已知下列热化学方程式:
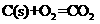
 =-393.5 kJ·mol-1
=-393.5 kJ·mol-1
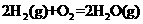
 =-483.6 kJ·mol-1
=-483.6 kJ·mol-1
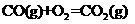
 =-283.0 kJ·mol-1
=-283.0 kJ·mol-1
由此可知反应: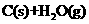 9
9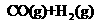 的焓变为_________。
的焓变为_________。
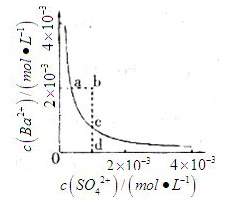 (3)某温度时
(3)某温度时 在水中的沉淀溶解平衡曲线如同所示。(提示
在水中的沉淀溶解平衡曲线如同所示。(提示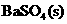 ⇋
⇋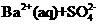 (aq)的平衡秆数
(aq)的平衡秆数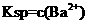 ·
·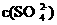 ,称为溶度积常数。)下列说法正确的是_____(填字母序号)。
,称为溶度积常数。)下列说法正确的是_____(填字母序号)。
A.加入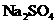 可以使溶液由a点变到b点
可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无 沉淀生成
沉淀生成
D.a点对应的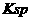 等于c点对应的
等于c点对应的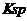
(4)在一固定体积的密闭容器中,进行如下化学反应:

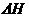 <0,其化学平衡常数K与t关系如下表:
<0,其化学平衡常数K与t关系如下表:
|
t/K |
298 |
398 |
498 |
…… |
K/(mol·L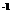 ) )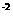 |
4.1×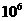 |
K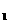 |
K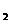 |
…… |
请完成下列问题:
①试比较K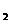 、K
、K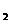 的大小,K1_______K2(填写“>”“=”或“<”)
的大小,K1_______K2(填写“>”“=”或“<”)
②下列各项能作为判断浚反应达到化学平衡状态的依据的是__________(填字母序号)。
A.容器内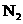 、
、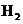 、
、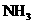 的浓度之比为1:3:2 B.
的浓度之比为1:3:2 B. 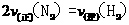
C.容器内坼强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改蛮 E.混合气体中各成分的浓度不再改变
9.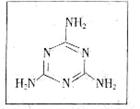 (17分)Ⅰ.据凤凰网2008年9月11号报道:近期甘肃等地报告多倒婴幼儿泌尿系统结石病例,调查表明与患儿食用三鹿牌婴幼儿配方奶粉含有的三聚氰胺有关。已知:三聚氰胺为白色晶体,将它用作
(17分)Ⅰ.据凤凰网2008年9月11号报道:近期甘肃等地报告多倒婴幼儿泌尿系统结石病例,调查表明与患儿食用三鹿牌婴幼儿配方奶粉含有的三聚氰胺有关。已知:三聚氰胺为白色晶体,将它用作
食品添加剂可提高食品中蛋白质的检测值,俗称“蛋白精”,结
构简式为如图所示,
请回答下列问题。
(1)三聚氰胺的分子式为 ____________________。
(2)已知氰胺分子中除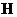 原子外,其他
原子外,其他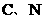 原子的最外层都满足8电子的结构,则氰胺分子的电子式为___________________。
原子的最外层都满足8电子的结构,则氰胺分子的电子式为___________________。
(3)三聚氰胺在强酸或强碱作用下水解的最终产物是三聚氰酸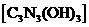 ,三聚氰酸可用于消除汽车尾气中的
,三聚氰酸可用于消除汽车尾气中的 。反应原理为:
。反应原理为: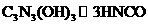 ;
;
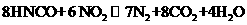 。下列说法正确的是___________(填字母序号)。
。下列说法正确的是___________(填字母序号)。
A.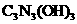 与
与 是同系物 B.
是同系物 B. 是一种强氧化剂
是一种强氧化剂
C. 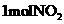 在反应中转移的电子为4mol D.反应中
在反应中转移的电子为4mol D.反应中 是还原剂
是还原剂
Ⅱ.顺丁烯二酸二甲酯是一种重要的有机化工原料,广泛应用于涂料,油漆,杀虫剂尤其是在水处理剂等方面。下面是利用石油产品M合成顺丁烯二酸二甲酯的部分过程
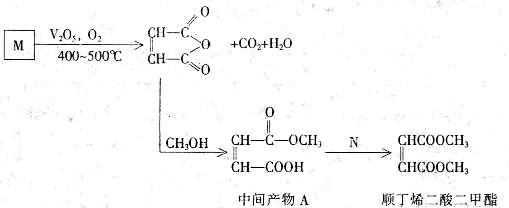
(1)已知烃M的相对分子质量为78.分于内含碳量为92.3%,所有C-H键和碳碳键类
型相同,化合物M的分子式为______________________。
(2)检验中间产物A含有的官能团为_____________________(填名称)。
(3)写出由中间产物A合成顺丁烯二酸二甲酯的方程式
__________________________________________________________________。
(4)中间产物A和足量的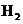 反应后,可得有机物
反应后,可得有机物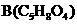 。
。
①写出B属于二酯且其核磁共振氢谱有两个吸收峰,峰的面积之比为3:1的结构简式________________________________;
②写出B属于二酯且其核磁共振氢谱有三个吸收峰,峰的面积之比为l:2:1的结构简式________________________________;
8.(22分)Ⅰ.盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜反应的情况,同答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入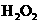 后,则可使铜溶解。该反应的离子方程式为_______________________________。
后,则可使铜溶解。该反应的离子方程式为_______________________________。
某同学未加入氧化剂,而是将它设计成一个电解
装置,也能使铜很快溶于稀盐酸。请在方格中画
出该装置:
(2)在一定体积的18 mol·L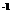 的浓硫酸中加入过量的铜片,加热使之反直,被还原的硫酸是0.9mol,则该硫酸的实际体积_______(填“大于”、“等于”或“小于”)100mL。有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?_______________(填“可行”或“不可行”)。
的浓硫酸中加入过量的铜片,加热使之反直,被还原的硫酸是0.9mol,则该硫酸的实际体积_______(填“大于”、“等于”或“小于”)100mL。有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?_______________(填“可行”或“不可行”)。
Ⅱ.某化学小组欲探究铁及其忱合物的氧化性和还原性,请回答下列问题:
试剂:铁粉、 溶液、
溶液、 ,溶液、氯水、锌片、铜片、
,溶液、氯水、锌片、铜片、 溶液。
溶液。
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是________________。
(2)实验记录(划斜线部分不必填写):
|
序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
|
① |
在 溶液中滴入适量氯水 溶液中滴入适量氯水 |
溶液由浅绿色变为棕黄色 |
|
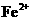 具有还原性 具有还原性 |
|
② |
在 溶液中加入锌片 溶液中加入锌片 |
|
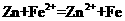 |
|
|
③ |
在 溶液中加入足量铁粉 溶液中加入足量铁粉 |
|
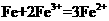 |
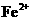 具有氧化性 具有氧化性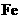 具有还原性 具有还原性 |
|
④ |
|
|
|
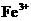 具有氧化性 具有氧化性 |
实验结论: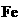 只有还原性,
只有还原性,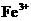 只有氧化性,
只有氧化性,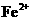 既有氧化性,又有还原性。
既有氧化性,又有还原性。
(3)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化_____________________________________________________,
并简述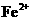 的检验的方法_________________________________________________________
的检验的方法_________________________________________________________
_____________________________________________________________________________。
7.(10分)已知在pH为4-5的环境中,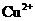 几乎不水解,而
几乎不水解,而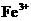 已完全水解,转化为
已完全水解,转化为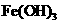 。某同学欲提纯含有少量
。某同学欲提纯含有少量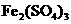 ,和稀硫酸的
,和稀硫酸的 溶液,并利用电解纯净的
溶液,并利用电解纯净的 溶液得到的数据,计算
溶液得到的数据,计算 的相对原子质量。
的相对原子质量。
 (1)向含有少量
(1)向含有少量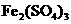 和稀硫酸的
和稀硫酸的 溶液中,加入稍过量的黑色粉末A搅拌、过滤,得到较纯净的
溶液中,加入稍过量的黑色粉末A搅拌、过滤,得到较纯净的 溶液。
溶液。
A的化学式为________________,加入A的作用是______________
________________________________________________________;
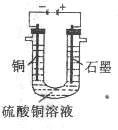
(2)将较纯净的 溶液故人右图所示的装置中进行电解,石墨电
溶液故人右图所示的装置中进行电解,石墨电
极上的电极反应式为______________________________________,
电解反应的离子方程式为__________________________________;
(3)实验完成后,石墨电极产生标准状况下的气体V mL,铜电极增重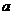
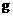 ,则Cu的相
,则Cu的相
对原子质量(用带有a、V的计算式表示)为________________________。
2.第Ⅱ卷共4页,用蓝、黑色墨水的钢笔或圆珠笔直接答在
试卷上。
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35-5
第Ⅱ卷(非选择题 共64分)
6.根据下列事买得出的结论正确的是( )。
A.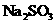


结论:此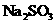 试样已变质
试样已变质
B.稀硫酸 产生气泡的速率较慢
产生气泡的速率较慢  产生气泡的速率明显加快
产生气泡的速率明显加快
结论: 对此反应有催化作用
对此反应有催化作用
C.某溶液 瓶口产生白雾
瓶口产生白雾 瓶口产生白烟
瓶口产生白烟
结论:此溶液一定为浓盐酸
D.无色试液 产生无色无味气体
产生无色无味气体  石灰水变浑浊
石灰水变浑浊
结论:原无色试液中可能含有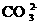
|
座位号 (准考证号末两位) |
|
|
|
|
右上角的“座位号”填写清楚。
5.用下列装置不能达到有关实验目的的是( )。
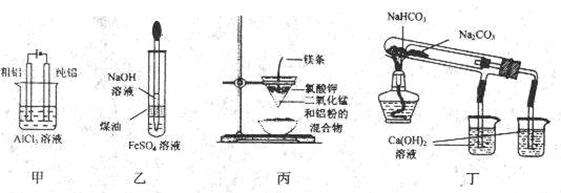
①用甲图装置电解精炼铝
②用乙图装置是为了较长时问地看到制备出来的白色的Fe(OH)2
③用丙图装置可制得金属锰
④用丁图装置验证 和
和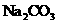 的热稳定性
的热稳定性
A.①② B.②③ C.③④ D.①④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com