
题目列表(包括答案和解析)
1. 现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
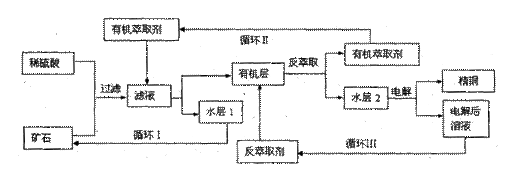
已知:①Cu+在酸性溶液中不稳定,可发生自身氧化还原反应;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1)矿石用稀硫酸处理过程中Cu2O发生反应的离子方程式为: ;
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是 。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层1暴露在空气中发生反应的离子方程式 。
(3)写出电解过程中阳极(惰性电极)发生反应的电极反应式: 。
(4)“循环III”中反萃取剂的主要成分是 。
7.某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:
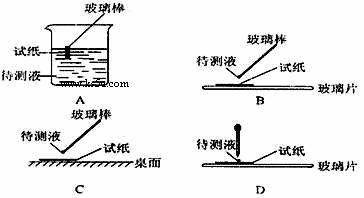
① 用蓝色石蕊试纸检测该溶液,试纸显红色;
② 取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色;
③ 取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④ 取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤ 取实验 ④ 后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
⑴在实验 ① 中,下图所示的操作中正确的是___________(填代号)。
⑵根据上述实验判断原溶液中肯定存在的离子是______________________,肯定不存在的离子是______________________。
⑶写出与②③两个实验有关的离子方程式:
②_____________________________________________________________
③_____________________________________________________________
6.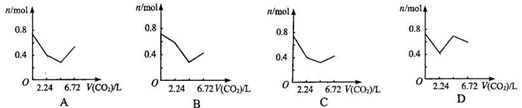 向含有0.2 mol氢氧化钠和0.1 mol氢氧化钙的溶液中,持续稳定地通入二氧化碳气体,通入气体为6.72 L(标准状况)时,立即停止,则这一过程中,溶液中离子数目与通入二氧化碳气体体积的关系正确的是(不考虑气体的溶解)
向含有0.2 mol氢氧化钠和0.1 mol氢氧化钙的溶液中,持续稳定地通入二氧化碳气体,通入气体为6.72 L(标准状况)时,立即停止,则这一过程中,溶液中离子数目与通入二氧化碳气体体积的关系正确的是(不考虑气体的溶解)
5.某溶液中含有NO3-、SiO32-、AlO2-、S2-等4种离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
A.只有S2- B.S2-和NO3-
C.SiO32-、S2-和NO3- D.四种离子都减少
4.(08江苏卷)下列文字表述与反应方程式对应且正确的是( )
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓
B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
C.利用腐蚀法制作印刷线路板:Fe3+ + Cu == Fe2+ + Cu2+
D.实验室用液溴和苯在催化剂作用下制溴苯: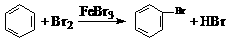
3.(08海南卷)在pH=13的无色溶液中,可以大量共存的一组离子是( )
A.NH4+、NO3- 、K+、SO42-
B.CO32_、NO3-、HCO3-、Na+
C.Na+、ClO-、AlO2-、NO3-
D.CrO42-、K+、Na+、SO42-
2.在一无色未知液中已检出有Al3+存在,在此溶液中能大量共存的离子组是
A.Na+、NH4+、NO3-、Cl- B.K+、Na+、HCO3-、Br-
C.Na+、H+、NO3-、S- D. K+、Fe2+、NO3-、Cl-
1.下列离子方程式错误的是
A.硫化钠溶液中加生产方式足量盐酸:S2-+2H+→H2S↑
B.向碳酸氢钙溶液中开始滴入氢氧化钠溶液:
Ca2++2HCO3-+2OH-→CaCO3↓+2H2O+CO32-
C.用硫酸铜溶液吸收硫化氢气体:Cu2++H2S→CuS↓+2H+
D.向浓氨水中开始滴入硫酸铝溶液:
A13++3NH3+H2O→A1(OH)3↓+3NH4+
7. 2007年10月是索尔维制碱法命名140周年纪念,1867年在巴黎世界博览会上,将氨碱法正式命名为索尔维制碱法。该法广泛为世界各国采用,后被中国的侯氏制碱法所取代。索尔维法的生产流程是:

索尔维法能实现连续生产,但食盐利用率只有70﹪,且副产品CaCl2没有用途,污染环境。
1940年我国化学家侯德榜先生经过多次实验,冲破了“索尔维法”的技术封锁,并加以改进,食盐利用率达96﹪,得到了纯碱和氯化铵两种产品,被称为“侯氏制碱法”。其基本原理是:
①在30℃-50℃的饱和食盐水中,先通入氨饱和,再通入CO2得碳酸氢钠沉淀。
②过滤,将滤渣加热而得副产品。
③在滤液中加入细食盐末,在10℃-15℃,使NH4Cl沉淀,过滤,滤液为饱和食盐水。
请完成下列问题:
(1)在氨的饱和NaCl溶液中通入CO2的两步反应方程式:
______ ___________。
(2)不能在NaCl溶液中通入CO2制NaHCO3的原因是____________________。
(3)析出小苏打的母液中加入生石灰的反应方程式:_______________。
(4)在“侯氏制碱法”中,_______物质可以循环利用,在“索尔维法”中___________物质可以循环利用。
(5)“侯氏制碱法”与“索尔维”相比,其优点是___________。
6.据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学反应方程式为:5KclO3+6P=3P2O5+5KCl,则下列有关叙述错误的是( )
A.上述反应中氧化剂和还原剂的物质的量之比为5:6
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中
的水分,生成磷酸小液滴(雾)
C.上述反应中消耗3molP时,转移电子的物质的量为15mol
D.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com