
题目列表(包括答案和解析)
4.已知A为酸式盐,B为某二价主族金属元素的化合物,常温常压下C、D、F、G、I均呈气态。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。

(1)写出B的电子式 ,D的结构简式 。
(2)写出A与B反应的化学方程式 。
(3)如对气体G进行加压操作,产生的现象是 。
(4)写出下列反应的离子方程式:
①在A溶液中加入M 。
②向A溶液中加入过量NaOH溶液,并加热 。
3.下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。

已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)F的化学式 ;G的水溶液中,最多的阳离子是 。
(2)写出K与H反应的离子方程式: ;
G与H反应的化学方程式: 。
(3)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。用化学平衡移动的原理加以解释
。
2. 右图是部分化学常见的氧化物和单质的转化关系。其中。气化物f是制造光导纤维的重要原料,氧化物c是一种具有磁性的黑色物质。回答下列问题:
右图是部分化学常见的氧化物和单质的转化关系。其中。气化物f是制造光导纤维的重要原料,氧化物c是一种具有磁性的黑色物质。回答下列问题:
(1)写出下列物质的化学式:单质C
氧化物d ;
(2)纯净的单质F在工业上的重要应用是
;
(3)写出下列反应的化学方程式:
① ;
④ ;
⑤ 。
1.A是单质,D是A单质所含元素的最高价氧化物的水化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应。已知有如下转化关系(部分产物和反应条件已略去);
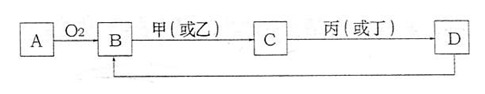
试回答:
(1)写出B转化为C的可能的离子方程式 。
(2)若C的溶液显酸性,用离子方程式表示其净水的原理 。
(3)若C为钠盐,用含m mol C的溶液与1Ln mol·L-1的盐酸充分反应,已知 ,则生成D的物质的量为 mol。
,则生成D的物质的量为 mol。
(4)用A单质和铂作电极,与海水、空气组成海洋电池,写出铂电极上发生反应的电极反应式 ;若负极材料消耗18g,则电池转移的电子总数为 (阿伏加德罗常数用NA表示)
4. 氯乙烯是合成聚氯乙烯(PVC)的单体。乙烯氧氯化法是生产氯乙烯的主要方法。分三步进行(如图所示)
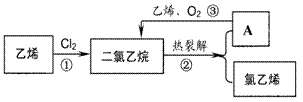
(l)下列关于乙烯、氯乙烯和聚氯乙烯的说法中,正确的是____ (填字母)。
A.都能在氧气中燃烧 B.都能发生加成反应使溴水退色
C.都能使酸性高锰酸钾溶液退色D.氯乙烯分子中所有原子处于同一平面
(2)从环境保护的角度分析,氧氯化法的优点是______

(3)某学生设计了下列反应:
请写出③的化学方程式
(4)己知二氯乙烷与Na0日溶液共热可生成乙二醇(HO-CH2CH2- OH ),请写出乙二醇与乙酸发生完全酷化反应的化学方程式_______________
(5)焚烧是废旧塑料的处理方法之一,但在焚烧过程中会排放出有毒物质。试写出聚氯乙 烯(PVC)塑料完全燃烧的化学方程式___________
3.2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾

功能衰竭。“亮菌甲素”的结构简式为 ,它配以辅料丙二醇溶成
针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为 。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其属于醇类的同分异构体的结构简式 。
(3)下列有关“亮菌甲素”的叙述正确的是 (填序号)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4退色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1mol“亮菌甲素”最多与2molNaOH反应
(4)核磁共振仪可以测定有机物分子中处于不同化学环境的氢原子及相对数量。氢原子在分子中的化学环境不同,在核磁谱图中就处于不同的位置,化学环境相同的氢原子越多,波谱峰积分面积越大(或高度越高)。核磁共振氢谱分析,发现二甘醇分子中有3个肿收峰,其峰面积之比为2:2:1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1mol二甘醇与足量的金属钠反应生成1molH2。写出二甘醇与乙酸(按物质的量之比1:1)反应的化学方程式
。
2.已知:HCN的结构为H-C≡N;

①R-CN RCOOH,
 ②R-Cl+CN-
R-CN+Cl-(R为烃基)。
②R-Cl+CN-
R-CN+Cl-(R为烃基)。
 玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:
玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:

⑴写出反应类型:② ,④ 。
⑵写出反应③的化学方程式: ;
写出能证明糠醛中含有醛基的一个化学反应方程式
。
⑶若E为环状化合物,则其结构简式 。
⑷若E为高聚物,则其结构简式 。
1.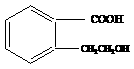 为有机物A的结构简式,可以通过不同的反应制得下列物质。
为有机物A的结构简式,可以通过不同的反应制得下列物质。

(1) 写出A → C的化学方程式: 。
(2) 推断B物质的结构简式 ;X反应类型是 ;由 D → E 所需的试剂是 。
(3) R物质属于A 的同分异构体,其性质如下:

试写出符合条件的R的同分异构体的结构简式(任写两种) : ; 。
6. 市场销售的某种食用精制盐包装袋上有如下说明(部分):
|
产品标准 |
 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
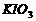 +
+  + H2SO4
+ H2SO4 ==  +
+  +
+ 
(2)上述反应生成的 可用四氯化碳检验。向碘的四氯化碳溶液中加入
可用四氯化碳检验。向碘的四氯化碳溶液中加入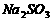 稀溶液,将
稀溶液,将 还原,以回收四氯化碳。
还原,以回收四氯化碳。
①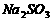 稀溶液与
稀溶液与 反应的离子方程式是
反应的离子方程式是
②某学生设计回收四氯化碳的操作步骤为:
a、将碘的四氯化碳溶液置于分液漏斗中;
b、加入适量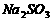 稀溶液;
稀溶液;
c、分离出下层液体。
以上设计中遗漏的操作及在上述操作中的位置是
(3)已知: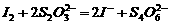
某学生测定食用精制盐的碘含量,其步骤为:
a、准确称取 食盐,加适量蒸馏水使其完全溶解;
食盐,加适量蒸馏水使其完全溶解;
b、用稀硫酸酸化所得溶液,加入足量 溶液,使食用盐中
溶液,使食用盐中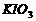 与
与 反应完全;
反应完全;
c、以淀粉溶液为指示剂,逐滴加入物质的量浓度为 的
的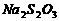 溶液
溶液 ,恰好反应完全。
,恰好反应完全。
①判断c中反应恰好完全依据的现象是
②根据以上实验和包装说明,所测精盐的碘含量是

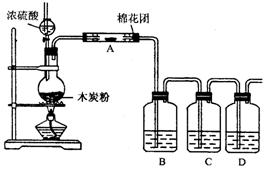
5.(1)下边装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气.
 答:________________________________________
_
答:________________________________________
_
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:__________________ .
(3)如果用图中装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是________,
作用是________ .
B中加入的试剂是________,
作用是________ .
C中加入的试剂是________,作用是除尽________气体.
D中加入的试剂是________,作用是_______ _.
(4)假设上述各步反应都能完全反应,则实验时C中应观察到的现象是________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com