
题目列表(包括答案和解析)
1.居室装修用石材的放射性常用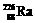 作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
A.一个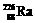 原子中含有138个中子 B.Ra元素位于元素周期表中第六周期ⅡA族
原子中含有138个中子 B.Ra元素位于元素周期表中第六周期ⅡA族
C.Ra是一种非金属元素 D.Ra(OH)2是一种两性氢氧化物
19.(8分)如图所示,A-I分别表示中学化学中常见的一种物质,它们之间的相互关系如下:A为坚硬难熔的主族元素的氧化物,D为紫红色固体单质且常温下能与浓HNO3反应生成H和红棕色气体,B为黑色固体。
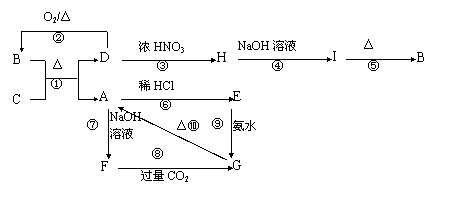
则(1)写出反应①、③的化学方程式
①
③
(2)写出反应⑧的离子方程式
(3)由③制备H不合理,请另设计一种由D制备H的合理方法:
泉州七中09届高三年上学期第三次月考化学试卷答题卡
(考试时间:12月13日下午9:50---11:20)
满分 100 命卷人:林志鹏 复核人:肖 衡
18.(12分) 白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸。
(1)白磷是_________晶体,31g白磷与足量的氧气完全燃烧释放出745.5kJ的热量,请写出白磷燃烧的热化学反应方程式:__________________________________
(2)已知白磷和氯酸溶液可发生如下反应:
□P4 +□HClO3 +□ --□HCl +□H3PO4
配平并完成上述反应方程式,该反应的氧化剂是______________。
(3)白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O = 20Cu3P + 24 H3PO4 + 60 H2SO4
该反应的氧化产物是___________,若有11mol P4反应,则有________mol电子转移。
17.(12分)某校学生课外活动小组为测定Na元素的相对原
子质量,设计的装置如右图,从实验室取出bg(不足量)的钠放
入水中,塞紧瓶塞,使钠完全反应,试回答:
(1)实验室取用一小块钠,需要的用品有_________________。
(2)此干燥管的作用是________________,若不用此干燥管,
则测出相对原子质量会比实际相对原子质量________(填“偏大”、“偏小”或“不变”,下同),若此钠块有极少量被氧化,则结果会_____________。
(3)有甲同学建议在图中干燥管上再第二个干燥管(设此干燥管质量为mg,包括干燥剂的质量),其目的是__________________,称得反应前装置(包括水和干燥剂)的总质量为ag。完全反应后再称量此装置的总质量为cg,且第二个干燥管质量变为m1g,则依甲同学建议,计算钠的相对原子质量的表达式为_______________。
16.(12分)市场上出售的“热敷带”的主要成分是铁屑、碳粉、木屑、少量的氯化钠、水等。“热敷带”启用之前用塑料袋密封,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会产生大量铁锈。
(1)“热敷带”涉及的电化学原理:__________
(2)碳粉的作用是: 氯化钠的作用是:_____________________________
(3)电极反应式: ;
______________________________________________
(4)铁锈是如何形成:______________________________________________________
15.(14分)有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径B>C;
②D、E、G是非金属元素,它们都可以跟氢化合生成气态氢化物HD、HE和HG,在室温时,G的单质与氢气暗处混合就爆炸,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
(1)A的名称是____________,B位于周期表中第_________周期________族,C的原子结构示意图是________________。
(2)E的单质颜色是____________________。
(3)A元素与D元素形成化合物的电子式是__________________。
(4)G的单质与水反应的化学方程式是______________________________。
(5)F的元素符号是_____________________。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是_________,酸性最强的化学式是_______________,气态氢化物最稳定的化学式是______________。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是:________________________________________。
14.已知氯化铁溶液中通入硫化氢可发生反应:2FeCl3+H2S→2FeCl2+S↓+2HCl。在标准状况下,向100mLFeCl3溶液中通入a L的H2S气体后,再加入足量的铁粉充分反应。所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为
A.1.5mol/L B.1 mol/L C.2 mol/L D.无法确定
第Ⅱ卷(共58分)
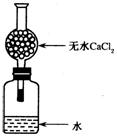
13.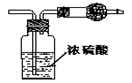 某无色气体可能由O2、CO2、HCl、NH3、NO、Br2中的一种或几种组成,通过图中洗气瓶后气体体积减少,通过干燥管后气体立即呈红棕色,则下列推断正确的是
某无色气体可能由O2、CO2、HCl、NH3、NO、Br2中的一种或几种组成,通过图中洗气瓶后气体体积减少,通过干燥管后气体立即呈红棕色,则下列推断正确的是
A、干燥管内固体一定为碱石灰 B、原气体中一定有NO和O2
C、原气体中一定有CO2、NO D、原气体中一定没有HCl、Br2
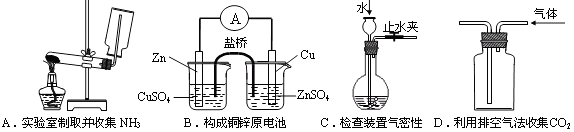
12.下列装置或操作能达到实验目的的是
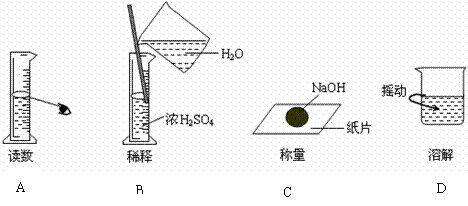
11.下图分别表示四种操作,其中有两个错误做法的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com