
题目列表(包括答案和解析)
15.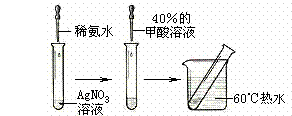
 (10分) 甲酸(CH2O2),俗称蚁酸,结构式为: 。某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证:
(10分) 甲酸(CH2O2),俗称蚁酸,结构式为: 。某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证:
 猜想I:甲酸具有酸性;
猜想I:甲酸具有酸性;
 实验I:在甲酸溶液中滴加紫色石蕊试液;
实验I:在甲酸溶液中滴加紫色石蕊试液;
 猜想II:甲酸能发生银镜反应;
猜想II:甲酸能发生银镜反应;
 实验II:操作过程如右图所示;
实验II:操作过程如右图所示;
 回答下列问题:
回答下列问题:
 ⑴请你再设计出至少2个实验方案来验证甲酸的酸性:
、
;
⑴请你再设计出至少2个实验方案来验证甲酸的酸性:
、
;
 ⑵请你进一步设计实验方案证明甲酸是弱酸:
;
⑵请你进一步设计实验方案证明甲酸是弱酸:
;
 ⑶依右上图所示的实验,加热20分钟后并没有出现预期的实验现象。该小组同学预期的实验现象是
,请你从理论上简单解释实验中没有出现该现象的原因
;
⑶依右上图所示的实验,加热20分钟后并没有出现预期的实验现象。该小组同学预期的实验现象是
,请你从理论上简单解释实验中没有出现该现象的原因
;
 ⑷在仔细分析甲酸分子组成元素的基础上,请你再提出一个甲酸在浓硫酸作用下可能具有的性质的猜想并设计一个实验方案验证你的猜想:
⑷在仔细分析甲酸分子组成元素的基础上,请你再提出一个甲酸在浓硫酸作用下可能具有的性质的猜想并设计一个实验方案验证你的猜想:
 ①你提出的猜想是
;
①你提出的猜想是
;

 ②你设计的实验方案是:
②你设计的实验方案是:

 实验方案请参考如下形式:
实验方案请参考如下形式:



13. 下列溶液中有关物质的量浓度关系正确的是
下列溶液中有关物质的量浓度关系正确的是
 A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合: c(H+) + c(M+) = c(OH-) + c(A-)
c(H+) + c(M+) = c(OH-) + c(A-)
 B. pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
B. pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
 C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
 c(CH3COO-) +2c(OH-)
== 2c(H+)
+ c(CH3COOH)
c(CH3COO-) +2c(OH-)
== 2c(H+)
+ c(CH3COOH)
 D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)

 14.在一密闭容器中有如下反应:aX(g)+bY(g)
14.在一密闭容器中有如下反应:aX(g)+bY(g) 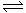 nW(g);ΔH=Q。某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH=Q。某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
 其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是
 A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
 B.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0
B.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0
 C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
 D.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
D.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
 第Ⅱ卷(共72分)
第Ⅱ卷(共72分)
12. 下列离子方程式正确的是
下列离子方程式正确的是
 A.碳酸钠溶液显碱性:CO32- + 2H2O
A.碳酸钠溶液显碱性:CO32- + 2H2O
 H2CO3
+2OH-
H2CO3
+2OH-
 B.过量铁粉溶于稀硝酸中:Fe + 4H+ + NO3-
== Fe3+ + NO↑+ 2H2O
B.过量铁粉溶于稀硝酸中:Fe + 4H+ + NO3-
== Fe3+ + NO↑+ 2H2O
 C.电解精炼铜的阴极反应是:Cu2++2e-=Cu
C.电解精炼铜的阴极反应是:Cu2++2e-=Cu
 D.向次氯酸钙溶液中通入少量二氧化硫:
D.向次氯酸钙溶液中通入少量二氧化硫: Ca2++ClO-+SO2+H2O=CaSO3↓+2HClO
Ca2++ClO-+SO2+H2O=CaSO3↓+2HClO
11. 在治疗禽流感、猪流感等流行性疾病的药物中,达菲是最为有效的药物,而莽草酸则是合成达菲的主要原料之一。莽草酸主要从传统香料茴香、八角中提取,鞣酸则广泛存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
在治疗禽流感、猪流感等流行性疾病的药物中,达菲是最为有效的药物,而莽草酸则是合成达菲的主要原料之一。莽草酸主要从传统香料茴香、八角中提取,鞣酸则广泛存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
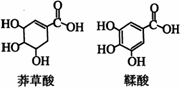 A.两种酸都能与溴水反应
A.两种酸都能与溴水反应
B.两种酸遇三氯化铁溶液都显色
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.等物质的量的两种酸与足量金属钠反应产生氢气的量相同
10.
 类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下表中有关推论正确的是
类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下表中有关推论正确的是
|
|
已知事实 |
推论 |
|
A |
Na2CO3溶液在空气中不易变质 |
水玻璃在空气中不易变质 |
|
B |
乙烯分子内所有原子在同一平面上 |
丙烯分子内所有原子在同一平面上 |
|
C |
乙烯在空气中燃烧有黑烟 |
苯在空气中燃烧产生的烟更浓 |
|
D |
Na在空气中燃烧生成Na2O2 |
Li在空气中燃烧生成Li2O2 |
9. 下列各组离子在指定条件下,-定能大量共存的是
下列各组离子在指定条件下,-定能大量共存的是
 ①能使红色石蕊试纸变蓝的溶液中:K+、Na+、CO32-、NO3-、AlO2-
①能使红色石蕊试纸变蓝的溶液中:K+、Na+、CO32-、NO3-、AlO2-
 ②c(H+)=10-1mol/L的溶液中:Cu2+、Al3+、SO42-、NO3-
②c(H+)=10-1mol/L的溶液中:Cu2+、Al3+、SO42-、NO3-
 ③能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
③能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
 ④水电离出的c(H+)=10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
④水电离出的c(H+)=10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
 ⑤在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-
⑤在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-
 ⑥在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
⑥在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
 A.①② B.①③ C.②④ D.②⑤⑥
A.①② B.①③ C.②④ D.②⑤⑥
8.一定质量 Cu与某浓度足量的HNO3反应,将放出的气体与1.12 L O2(标准状况下)混合后,通入水中,恰好被全部吸收,则Cu的质量为
A.3.2g B.4.8g C.6.4g D.10.8g
7.设NA表示阿伏加德罗常数,下列叙述中正确的是
 A. 1 L pH为3的FeCl3溶液中,由水电离产生的H+离子数目为0.1NA
A. 1 L pH为3的FeCl3溶液中,由水电离产生的H+离子数目为0.1NA
 B.
B.  1molNa2O2与足量CO2反应转移的电子数NA
1molNa2O2与足量CO2反应转移的电子数NA
 C. 100 mL 0.5 mol/L的(NH4)2SO4溶液中,含有0.1NA个NH4+
C. 100 mL 0.5 mol/L的(NH4)2SO4溶液中,含有0.1NA个NH4+
D.常温常压下,22.4L的D2、H2组成的气体分子数为NA
6.目前市场上的手提应急灯,主要是“无液干粉”铅酸蓄电池,其原理是将有腐蚀性的浓硫酸灌注到硅胶凝胶中去,使电解质溶液不易发生泄漏,大大改善了电池的性能。所用的原料仍然是铅--二氧化铅--硫酸。下列关于该铅酸蓄电池的说法正确的是
A.充电时电源的正极接蓄电池标“+”的一极
B.“无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的反应原理
C.放电时在铅酸蓄电池的负极发生还原反应
D.充电时铅酸蓄电池上标有“-”的电极发生氧化反应
5.高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3 +3ClO -+4OH- =2FeO42- +3Cl- +5H2O ,
干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑
则下列有关说法不正确的是
A.高铁酸钾中铁显+6价 B.湿法中FeO42-是氧化产物
C.干法中每生成1mol Na2FeO4 转移4mol电子
D.K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com