
题目列表(包括答案和解析)
4.
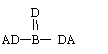 A、B、C、D四种短周期元素,其核电荷数依次增大,已知元素A和D可形成两种常温下均为液体的化合物,B原子最外层电子数是最内层电子数的两倍。则下列由四种元素形成的化合物的化学式不正确的是
A、B、C、D四种短周期元素,其核电荷数依次增大,已知元素A和D可形成两种常温下均为液体的化合物,B原子最外层电子数是最内层电子数的两倍。则下列由四种元素形成的化合物的化学式不正确的是
A.B2A6CD2 B. C. D.B2A5D2C
3.设NA为阿伏加德罗常数,则下列叙述中正确的是
A.1 mol C4H10中含有共用电子对数是12NA
B.22.4 L O2和O3的混合气体中分子数为NA
C.28.6 g Na2CO3·10H2O(M=286)晶体溶于水,所得溶液中CO32-个数为0.1NA
D.28 g N60(结构如右图)单质中含有的N-N键个数为3NA
2.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据化合物溶于水是否能导电判断是否是电解质; ②根据化合物溶于水是否能导电判断是否是离子化合物; ③根据酸分子中氢原子个数将酸分为一元酸、二元酸等; ④根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应; ⑤根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液; ⑥根据反应中的热效应△H值的正负将化学反应分为自发反应和非自发反应
 A.①④⑥ B.②③④ C.③④⑤ D.仅④
A.①④⑥ B.②③④ C.③④⑤ D.仅④
1.继三聚氰胺奶粉案后,有关部门在部分奶粉中检出了“皮革水解蛋白粉”,下列有关“皮革水解蛋白粉”说法正确的是
A.“皮革水解蛋白粉”是利用皮革下脚料甚至动物毛发等物质,经水解而生成的一种粉状物,因其氨基酸或者说蛋白含量较高,故添加到牛奶中,对人体无害。
B.三聚氰胺俗称“蛋白精”, 与“皮革水解蛋白粉”一样,是一种蛋白质。
C.“皮革水解蛋白粉”添加到乳制品、乳饮料当中,检测起来难度比三聚氰胺大。
D.向牛奶中添加“皮革水解蛋白粉”,与添加三聚氰胺的目的一样,都是为了以造假的手段提高牛奶中蛋白质的含量。
21.(12分)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
⑴配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
 ⑵配合物
⑵配合物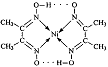 分子内的作用力有
(填编号)。
分子内的作用力有
(填编号)。
A.氢键 B.离子键 C.共价键 D.配位键
⑶很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③ 、④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序号),预测HCHO分子的立体结构为
形。
、④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序号),预测HCHO分子的立体结构为
形。
⑷氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点。该晶体的化学式 。
20. (10分) 工业上用丁烷氧化法制醋酸,反应的化学方程式可表示为:
2C4H10+5O2 4CH3COOH+2H2O
4CH3COOH+2H2O
现用58吨丁烷为原料制取醋酸,求:
(1)理论上需要标准状况下的空气 m3(设空气中O2、N2的体积分数分别为0.2、0.8),同时生成水 吨。
(2)若生成的醋酸溶解在生成的水中,所得醋酸的质量分数为 %。
(3)若同时生产质量分数为100%的冰醋酸m1吨和质量分数为50%的醋酸m2吨,且m1/m2=x,需补充水y吨,则y与x的关系式为 ;若不补充水,则m1+m2= 。
19.《茉莉花》是一首脍炙人口的中国江苏民歌。茉莉花香气的成分有多种,
(乙酸苯甲酯)是其中的一种,它可以从茉莉花中提取,也可以乙烯和甲苯为原料进行人工合成。其中一种合成路线如下:

回答下列问题:
(1)A、B的结构简式为__________ _ __,________ _____;
(2)写出反应②、⑥的化学方程式______ _ _______, ;
(3)上述反应中属取代反应 的有_______________________;(填写序号①②)
(4)反应__________(填序号)原子的理论利用率为100%,符合绿色化学的要求。
18. (8 分)高氯酸(HClO4)常用于塑料、电镀、人造金刚石工业,亚氯酸钠(NaClO2)是一种新型的优良漂白剂。高氯酸联产亚氯酸钠的工艺流程如下:

(1)反应器1中发生反应的化学方程式为____________________________________。
(2)通入反应器2的SO2作用是________;反应器2中发生反应的离子方程式为
_ _ __________。
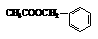 (3)循环1利用的物质是_______________。
(3)循环1利用的物质是_______________。
17. (12分)近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式: ;
② 写出步骤(III)反应的离子方程式: 。
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
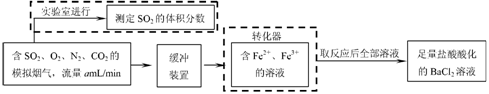

① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。

A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是
(3)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是 。
(4)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+1/x Sx 、
CO+1/x Sx=COS、2COS+SO2=2CO2+3/xSx 。其中COS中“C”化合价为 。
(5)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
16. (8分)根据下列框图关系填空,已知反应①、③是工业生产中的重要反应,D、E常温下为气体、X常温下为无色液体,H与E相对分子质量之间的关系为:Mr(H)-Mr(E)=34,又知C焰色反应通过蓝色钴玻璃火焰呈紫色。
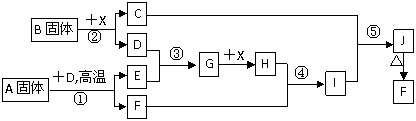
(1)固体B的电子式为 ,其中所包含的化学键有 。
(2)固体A的化学式为 ,其中非金属元素的化合价为 。
(3)反应④的离子方程式 。反应⑤的化学方程式 。
(4)用铜作电极电解H溶液,阳极的电极反应式是 。
(5)若生成16gE,放出106.5kJ热量,则1 mol A与足量D反应放出热量为: kJ。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com