
题目列表(包括答案和解析)
25. 某同学为探究氮的化合物的性质,设计了如下图所示的实验。A中所用实验物质只能由下列物质中选取:①Na2CO3 ②NaHCO3 ③NH4HCO3 ④NH4Cl,其中F是一种具有弹性的塑料贮气袋。
某同学为探究氮的化合物的性质,设计了如下图所示的实验。A中所用实验物质只能由下列物质中选取:①Na2CO3 ②NaHCO3 ③NH4HCO3 ④NH4Cl,其中F是一种具有弹性的塑料贮气袋。
按上图连接好装置进行实验,先将C处的Pt丝加热至红热,再将A试管中的物质加热,片刻后撤去C处的酒精灯,部分实验现象如下:Pt丝继续保持红热;D中的Cu片慢慢溶解。
(1)若A试管中的物质为纯净物,则该物质为 (填题中给出物质的序号)。
(2)B装置的作用是 。
(3)C装置中的Pt丝网作催化剂,在其催化作用下发生反应的化学方程式是:
。
(4)假如实验前装置中的空气已经排尽,且D中没有Cu片,欲使气体流入D后恰好溶解,则应在A中补加一种物质,该物质是 (填题中给出物质的序号),其与原来A中物质的物质的量之比为 (设所有物质完全反应)。
24、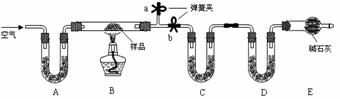 有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
⑴加热前通入空气的目的是:
。
操作方法是_________________。
⑵装置A、C、D中盛放的试剂分别为A___________,C__________,D__________。
⑶若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将__________(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将___________;若撤去E装置,则测得Na2CO3·10H2O的含量__________。
⑷若样品质量为 w g,反应后C、D增加的质量分别为 m1 g、m2 g,由此可知混合物中NaHCO3质量分数为_____________________(用含w、m1、m2的代数式表示)
23.现有含CaO杂质的CaC2试样。某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度。请填写下列空白:
(1)第一种方案:请从下图中选用适当的装置,设计一个实验,测定CaC2试样的纯度。
①所选用装置的连接顺序应是(填各接口的字母):____________________________。
②若实验时称取的试样为1.40g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为______________。
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数。先称取试样1.60g、锥形瓶和水的质量为195.00g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表:
|
|
读数次数 |
质量/g |
|
|
第1次 |
196.30 |
|
第2次 |
196.15 |
|
|
锥形瓶十水十试样 |
第3次 |
196.05 |
|
|
第4次 |
196.00 |
|
第5次 |
196.00 |
计算CaC2的质量分数时,必需用的数据是_____________________。不必作第6次读数的原因是____________________________________________。
(3)第三种方案:称取试样1.60g,操作流程如下:

①操作Ⅱ的名称是________________________。
②还需直接测定的物理量是_______________________________。
③在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果_________(填“偏大”、“偏小”或“不变”)。
22、某同学设计了如下图所示的装置,用于制取气体和验证某种物质的性质实验。
 (1)回答下列问题:
(1)回答下列问题:
①若装置Ⅱ中试管内盛有某种红色溶液,B为短周期中某种金属单质(不与冷水反应),A为无色粘稠状液体。实验过程中,观察到Ⅱ中试管内红色溶液逐渐褪色,但加热此溶液后,又恢复原先的红色。
则A与B反应的化学方程式是:
。
②若装置Ⅱ中试管内盛有某种紫色溶液,B为紫黑色固体,A为无色溶液。实验过程中,观察到产生的有色气体通入Ⅱ中试管内,紫色溶液先变红,后褪色。
则A与B反应的离子方程式是 。
③若B为铜粉,Ⅱ中试管内盛有某种无色溶液,当A中液体滴入烧瓶中与铜粉接触后,观察到产生的有色气体通入Ⅱ中试管内,无色溶液变蓝。
则Ⅱ中试管内试剂是 ,A与B反应的化学方程式是 。
(2)仪器D在此实验中的作用是 。

21、从下图中选用合适的装置,完成下列实验(其中,a、b为直流电源的两极)。
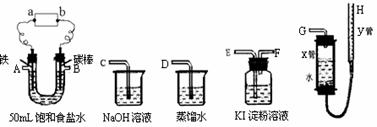 实验要求:电解50mL饱和食盐水,利用产生的氯气制取消毒液(NaClO溶液),并通过测定所产生的氢气的体积来计算电解后溶液的pH。
实验要求:电解50mL饱和食盐水,利用产生的氯气制取消毒液(NaClO溶液),并通过测定所产生的氢气的体积来计算电解后溶液的pH。
(1)a为直流电
源的 极,铁棒上的电极反应式是 。
(2)上述实验装置各管口连接的顺序是 A、B 。
(3)电解停止后,测量产生氢气体积。在正确读数前,必须注意的操作是什么?
答: 。
(4)当制得44.8 mL(标准状况)H2后,停止通电,U形管中还有NaCl剩余,此时溶液的体积为40 mL,设所产生的Cl2全部逸出,最终所得溶液的pH为_________。
(5)若将少量的Cl2通入水中达平衡后,再通入少量的Cl2,此时溶液中次氯酸根离子物质的量浓度与氢离子物质的量浓度之比[c(ClO-)/c(H+)]较原先 (填“增大”、“减小”、“不变”或“无法确定”)。
20、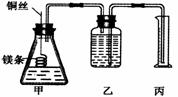 某研究性学习小组为证明在同温同压下,相同浓度、相同体积的酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积,设计的简易实验装置如下图。该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度、相同体积的酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积,设计的简易实验装置如下图。该实验的主要操作步骤如下:
I.①配制浓度均为0.5 mol/L H2SO4和H2C2O4溶液;②用 量取10.00 mL 0.5 mol/L H2SO4的和H2C2O4溶液分别加入两个锥形瓶中; ③称取除去表面氧化膜的镁带并系于铜丝末端。④检查装置的气密性,在广口瓶中装满水,按图连接好装置;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 ;⑥反应结束后,读取量筒内水的体积为y mL。
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm398%的浓H2SO4配制浓度为0.5 mol/L的H2SO4溶液,所需要的主要仪器有 。
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积。这三步操作的正确顺序是 。
(3) 读取量筒内水的体积时,若丙中液面高于乙中液面,如何使乙、丙中液面相平 。
(4) 简述速率不等的原因 ,铜丝不与酸接触的原因是 。
19、下列有关说法和实验操作正确的是_______________。
A.所有用到胶头滴管滴加液体的实验,均不可以将胶头滴管伸入试管中,均不可碰到试管壁
B.为了使硫酸和锌制取氢气的速率加快,可将锌加入到含有少量硫酸铜的稀硫酸中。
C.制取肥皂时,为了使皂化反应在均匀的体系中进行并加快反应速率,一般要在原料中加入一定量的酒精。
D.用渗析法分离淀粉中混有的NaCl杂质
18、如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述中不正确的是( )
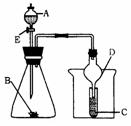 A.若A为醋酸,B为贝壳(粉状),C为饱和Na2CO3溶液,则C中无现象
A.若A为醋酸,B为贝壳(粉状),C为饱和Na2CO3溶液,则C中无现象
B.若A为食盐水,B为电石,C中盛KMnO4溶液,则C中溶液褪色
C.若A为浓氨水,B为生石灰,C中盛滴有酚酞的水,则C中溶液变红
D.实验中仪器D可起到防倒吸的作用
2009届高三实验专题练习
(第Ⅱ卷,非选择题)
17、 按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体可能是( )
按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体可能是( )
A、H2
B、CO和H2
C、NH3
D、CH3CH2OH(g)
16、下列对实验仪器名称的标注或实验操作,正确的是( )

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com