
题目列表(包括答案和解析)
13.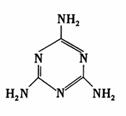 三聚氰胺的结构如右图。“三聚氰胺”,有个貌似美妙的别名“蛋白精”,某些广告中曾公然标榜“能提高产品蛋白含量”。三聚氰胺性状为纯白色单斜棱晶体,无味,密度1.573g/cm3.(16℃)常压熔点354℃(分解);快速加热升华,升华温度300℃,溶于热水,微溶于冷水。关于三聚氰胺,下列说法不正确的是
三聚氰胺的结构如右图。“三聚氰胺”,有个貌似美妙的别名“蛋白精”,某些广告中曾公然标榜“能提高产品蛋白含量”。三聚氰胺性状为纯白色单斜棱晶体,无味,密度1.573g/cm3.(16℃)常压熔点354℃(分解);快速加热升华,升华温度300℃,溶于热水,微溶于冷水。关于三聚氰胺,下列说法不正确的是
A.可以与盐酸反应
B.是有机物,有弱碱性
C.将购回的奶粉溶于热水后冷却,过滤,可以粗略检测其中是否含
有三聚氰胺
D.是蛋白质
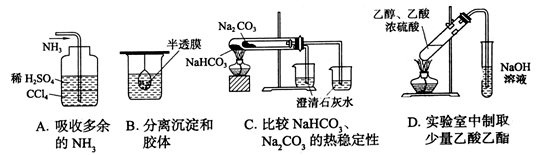
12.用下列实验装置完成对应的实验,能达到目的的是
11.用某氢氧燃料电池(用氢氧化钾水溶液为电解质溶液)电解饱和亚硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极。下列说法正确的是
A.当燃料电池正极消耗mg气体时,电解池阴极同时有mg气体生成
B.电解池的阳极反应式为: 4OH--4e-=O2↑+2H2O
C.电解池中溶液pH变小
D.燃料电池中溶液pH变大
10.下列事实不能用勒沙特列原理解释的是
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③实验室可用排饱和食盐水的方法收集氯气
 ④常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5
④常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5
⑤钠与氯化钾共融制备钾Na(l)+KCl(l) K(g)+NaCl(l)
⑥二氧化氮与四氧化氮的平衡体系,加压后颜色加深
A.②③ B.②⑥ C.①③④⑤ D.②③⑥
9.t℃时,将300 g A的不饱和溶液均分为三份,分别加热蒸发,然后冷却为t℃,已知三份溶液分别蒸发水x g、y g、w g,析出A晶体(不含结晶水)的质量依次为a g、b g、c g(a、b、c都不为零),且x+y=w。则下列说法正确的是
A.a+b>c B.a+ b = c
C.t℃时,A的溶解度为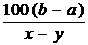 g
D.t℃时,A的溶解度为
g
D.t℃时,A的溶解度为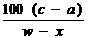 g
g
8.下列离子方程式表达正确的是
A.FeCl3溶液与过量Na2S溶液混合:2Fe3++S2-═2Fe2++S↓
B.Ca(HCO3)2溶液与Ca(OH)2溶液任意比混合;Ca2++HCO3-+OH-═CaCO3↓+H2O
C.NH4HCO3溶液中加足量NaAlO2溶液:NH4++AlO2-+2H2O= NH3·H2O+ Al(OH)3↓
D.少量SO2气体通入NaClO溶液中:SO2 + 2ClO-+ H2O = SO32-+ 2HClO
7.设NA代表阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L NH3气体溶于l L水中得到0.1 mol/L的氨水
B.500 mL 0.2 mol/L的K2SO4溶液中含有的微粒总数为0.3 N A
C.0.4 mol乙炔和乙醛混合气体,在氧气中充分燃烧,消耗氧气的分子数为NA
D.质子总数为10 NA的重水(D2O)的质量为18 g
6.下列叙述正确的是
A.合成氨工业采用500℃的较高温度是根据平衡移动原理得出的结论
B.黑色物质也能造成“白色污染 ”
C.绿色化学的核心思想是利用绿色植物治理环境污染
D.棉、丝、毛及合成纤维完全燃烧都只生成H2O和CO2,对环境不会有影响
21.(12分)
A.分子式为Pt(NH3)2Cl2的配位化合物有顺铂和反铂两种同分异构体。顺铂的结构式为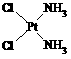 ,具有抗癌作用;反铂的结构式为
,具有抗癌作用;反铂的结构式为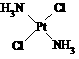 ,无抗癌作用。
,无抗癌作用。
⑴ C、N、O三种元素的电负性由大到小的顺序是 ;Ni元素与Pt元素位于同一族,写出Ni元素基态原子的电子排布式: 。
⑵ 顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由: 。
⑶ 金属铂的原子堆积方式为与铜型(面心立方堆积),一个金属铂的晶胞中含有 个铂原子。
⑷ NH3还能与很多化合物通过配位键发生相互作用。例如:科学家潜心研究的一种可作储氢材料的化合物 X是NH3与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体;加热化合物 X会缓慢释放H2,转变为化合物Y,Y是乙烯的等电子体。
① 化合物X的结构式为 (必须标明配位键)。
② 化合物X、Y分子中,N元素分别发生了 杂化。
20.(10分)现代化学工业遵循可持续发展原则,利用淀粉、纤维素等可再生资源合成多种化工产品。
⑴ 以淀粉为原料可制取香料乙酸乙酯,生产流程为:
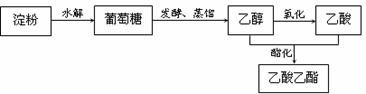
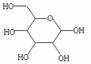 ① 部分链状葡萄糖分子在水溶液中通过分子内加成反应,以六元环或五元环的形式存
① 部分链状葡萄糖分子在水溶液中通过分子内加成反应,以六元环或五元环的形式存
在,其中六元环的结构为 ,则葡萄糖在水溶液存在的五元环结构为 ▲ 。
② 若用1000 kg 含(C6H10O5)n 90%的淀粉(杂质不参与反应)为原料制取乙酸乙酯。生产中,淀粉的水解率为90%,乙醇的产率为85%,酯化反应中乙醇、乙酸的转化率均为90%。计算生产中得到的乙酸乙酯的质量(kg)。
⑵ 纤维素的结构可表示为[(C6H7O2)(OH)3]n。10.00 g脱脂棉花(纤维素含量为100%)与乙酸、乙酸酐[(CH3CO)2O]的混合物在一定条件下发生酯化反应,可制得15.19 g醋酸纤维 (纤维素乙酸酯)。请通过计算推断该醋酸纤维的结构简式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com