
题目列表(包括答案和解析)
19.(11分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂
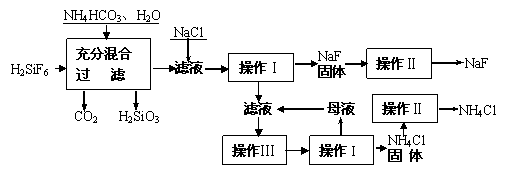 和生产含氟牙膏等。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
和生产含氟牙膏等。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
有关物质在水中溶解度见下表。请回答下列问题:
|
温度 |
10℃ |
20℃ |
30℃ |
溶解度:20℃NaF-4g;0℃NH4F-100g; 常温Na2SiF6-微溶于水 |
|
NH4Cl溶解度 |
33.3g |
37.2g |
41.4g |
(1)操作Ⅰ需要用到的玻璃仪器有玻璃棒、烧杯、 。
(2)上述流程中发生两步化学反应,第一步反应的化学方程式为:
,第二步反应的化学方程式为 。
(3)操作II的作用是 ;操作Ⅲ的具体过程是
。
(4)流程中NH4HCO3必须过量,其原因是 。
(5)NaF可用于生产含氟牙膏,使用含氟牙膏可以预防龋齿。请说明含有NaF的牙膏如何将羟基磷酸钙[Ca5(PO4)3(OH)]转化为更难溶的氟磷酸钙[Ca5(PO4)3F]
。
18.下表对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是
|
选项 |
陈述I |
陈述Ⅱ |
判断 |
|
A |
金属钠与冷水反应 |
惰性电极电解NaCl水溶液得不到金属钠 |
I对;Ⅱ对;无 |
|
B |
二氧化硅能与烧碱溶液反应 |
不能用带毛玻璃塞的试剂瓶存放烧碱溶液 |
I对;Ⅱ对;有 |
|
C |
氨气极易溶解于水 |
氨气与浓HCl气体相遇会产生白烟 |
I对;Ⅱ错;无 |
|
D |
蔗糖、淀粉、纤维素水解产物都能发生银镜反应 |
蔗糖、淀粉、纤维素互为同分异构体 |
I对;Ⅱ对;有 |
16. 高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3 +3ClO -+4OH- =2FeO42- +3Cl- +5H2O ,
干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑
则下列有关说法正确的是
A.高铁酸钾中铁显+6价 B.湿法中FeO42-是还原产物
C.干法中每生成1mol Na2FeO4 转移4mol电子 D.K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质
17.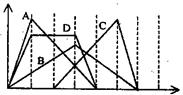 右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列选项番号对应的曲线编号错误的是
右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列选项番号对应的曲线编号错误的是
A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中
通入CO2至沉淀消失
15. .将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2构成甲烷燃料电池。下列
有关叙述正确的是
A.负极的电极反应为:CH4+10OH--8e-=CO32-+7H2O
B.正极发生氧化反应,电极反应为:O2+2H2O+4e-=4OH-
C.该电池使用一段时间后应补充KOH D. 燃料电池工作时,溶液中的OH-向正极移动
14. 对下列各溶液的叙述正确的是
A.0.1mol/L的(NH4)2SO4溶液中: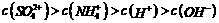
B.将0.1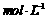 醋酸溶液加大量水稀释后,溶液的pH增大
醋酸溶液加大量水稀释后,溶液的pH增大
C.Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D.25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度的关系:
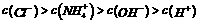
13.能正确表示下列反应的离子方程式是
A.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
B.向漂白粉溶液中通人SO2气体:Ca2++2C1O-+SO2 =CaSO3↓+2HC1O
C.向小苏打溶液中加入醋酸:HCO3-+ CH3COOH=CO2↑+ H2O+ CH3COO-
D.稀硝酸中加入过量铜片:3Cu +8H++2NO3-= 3Cu2++2NO↑+ 4H2O
12.下列说法正确的是
A.常温下,1L0.1mol·L-1CH3COOH溶液中含CH3COO-数为6.02×1022
B.标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为6.02×1023
C.含1mol硅原子的SiO2晶体中Si-O键的个数为6.02×1023
D.分解H2O2制O2,每生成1molO2转移1.204×1024个电子
11. W、X、Y、Z为同一短周期元素,原子序数依次增大。已知W、Y、Z三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。下列判断正确的是
A.Z元素在第三周期第VIA族 B.W、Y、Z三种元素中有两种金属、一种非金属
C.W、X、Y三种元素的单质熔、沸点依次降低
D.W、Y、Z三种元素的最高价氧化物的水化物有两种是强碱、一种是强酸
10.下列对实验操作的叙述错误的是
A.点燃可燃性气体前都要先检验纯度 B.酸碱液溅到眼睛里,立即用大量水冲洗
C. 测定溶液的pH试纸要用水先润湿 D.给试管加热时,先均匀预热后局部加热
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com