
题目列表(包括答案和解析)
22. (13分)氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
(13分)氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
□SiO2+□C+□N2 □Si3N4+□CO
□Si3N4+□CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是__________,其还原产物是_____________。
(3)该反应的平衡常数表达式为K =_______________________;
(4)将知上述反应为放热反应,则其反应热DH________零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值_______(填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v (CO) =18 mol/(L·min),则N2消耗速率为
v (N2) = mol/(L·min)。
21. (10分)某白色粉末可能含有K2SO4、NH4Cl、NaCl。请设计合理实验探究该白色粉末的组成。
(10分)某白色粉末可能含有K2SO4、NH4Cl、NaCl。请设计合理实验探究该白色粉末的组成。
限选实验仪器与试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、1mol·L-1硫酸、1mol·L-1硝酸、1mol·L-1盐酸、2mol·L-1NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
完成以下实验探究过程:
(1)提出假设:根据题意,该白色粉末的组成有______种可能的情况。
(2)设计实验方案
基于该粉末中上述三种盐均存在这一假设,设计出实验方案(不要在答题卡上作答)。
(3)根据(2)的实验方案,叙述实验操作、预期现象和结论。
|
实验操作 |
预期现象和结论 |
|
步骤1: |
|
|
步骤2: |
|
|
步骤3: |
|
|
步骤4: |
|
|
…… |
|
20.
 (12分)某试剂厂用银(含杂质铜)和硝酸(含Fe3+)反应制取硝酸银,步骤如下:
(12分)某试剂厂用银(含杂质铜)和硝酸(含Fe3+)反应制取硝酸银,步骤如下:
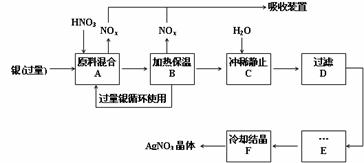
(1)工业上一般选用中等浓度的硝酸和银反应来制取硝酸银。请在下表空格处填空。
|
|
优点 |
缺点 |
|
使用浓硝酸 |
反应速率快 |
酸耗较大,产生NOx的量较多 |
|
使用稀硝酸 |
|
|
(2)步骤B加热保温的作用是 :
a. 有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中H+的浓度
(3)步骤C是为了除去Fe3+、Cu2+等杂质,冲稀时产生沉淀的原因是 ;
(4)步骤C中加水的量应该适量,若加入过多的水,对后续步骤造成的不良影响是:
;
(5)步骤E进行的操作是 。
(6)制得的硝酸银中含有少量硝酸铜,通常除去硝酸铜的方法是在步骤E之前加适量新制的Ag2O,使Cu2+转化为Cu(OH)2沉淀,反应后过滤除去。该反应的化学方程式为: 。
19. (12分)在实验室里可用下图所示装置(夹持装置末画出)制取氯酸钾、次氯酸钾和探究氯水的性质。
(12分)在实验室里可用下图所示装置(夹持装置末画出)制取氯酸钾、次氯酸钾和探究氯水的性质。
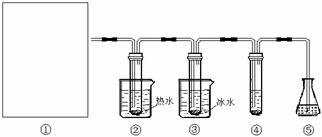
图中:①为氯气发生装置;②试管里盛有15mL 30%KOH溶液,并置于水浴中;③试管里盛有15mL 8% KOH溶液,并置于冰水浴中;④试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)在答题卡方框中画出二氧化锰和浓盐酸制取氯气的装置图
(铁架台和加热装置可不画出)
(2)制取氯气时,向烧瓶中加入适量浓盐酸的操作是 。
(3)比较制取氯酸钾和次氯酸钾的条件,二者的差异是: 。
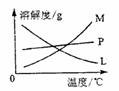 反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是 (填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验名称)。
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是 (填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验名称)。
(4)本实验中制取氯酸钾的离子方程式是 。
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液初从紫色逐渐变为 色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
|
|
然后溶液从无色逐渐变为 色 |
|
18.某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图II所示。则下列结论正确的是
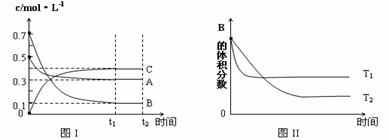
A.该反应的热化学方程式为 :A(g
)+3B(g) 2C(g)
;△H>0
2C(g)
;△H>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
D.若保持温度和体积不变,起始投料0.2mol A、0.2mol B、0.1mol C,达到新平衡中B的体积分数与原平衡相等
0.1mol电子
B.电池放电时,负极反应为:3NaBr-2e-=NaBr3+2Na+
C.充电过程中钠离子从右到左通过离子交换膜
D.放电过程中钠离子从右到左通过离子交换膜
17.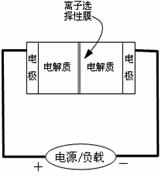
 右图是一种正在投入生产的大型蓄电系统的原理图。电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过。电池充、放电的化学反应方程式为:
右图是一种正在投入生产的大型蓄电系统的原理图。电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过。电池充、放电的化学反应方程式为:
 ,
,
下列关于此电池说法正确的是
A.充电的过程中当0.1mol Na+通过离子交换膜时,导线通过
16. 右表为元素周期表前四周期的一部分,W、X、Y、Z四种元素的位置关系如表中所示。下列有关叙述中正确的是
右表为元素周期表前四周期的一部分,W、X、Y、Z四种元素的位置关系如表中所示。下列有关叙述中正确的是
A.Z元素在元素周期表的第四周期VII族
B.Y、Z的简单离子中电子总数相差8个
C.W的氢化物的沸点比X的氢化物的沸点高
D.根据原子结构,X与Y元素的性质可能具有相似性
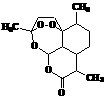
15.复方蒿甲醚是目前国际上广泛认可的中国原创药品,它在疟疾这一高
传染性疾病治疗史上具有里程碑的意义,主要成分是青蒿素,结构如
右图。下列有关青蒿素的叙述中正确的是
A.青蒿素的化学式为:C16H20O5
B.一定条件下,该有机物能和NaOH溶液反应
C.青蒿素易溶于水
D.由于青蒿素中含有过氧键-O-O-,一定条件下其可能具有较强的氧化性
14.有一无色溶液,可能含有K+、A13+、Mg2+、NH4+、C1-、SO42-、HCO3-、MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确是
A.肯定有A13+、Mg2+、SO42- B.可能有K+、C1-、MnO4-
 C.肯定有A13+、Mg2+、NH4+、C1- D.肯定有K+、HCO3-、MnO4-
C.肯定有A13+、Mg2+、NH4+、C1- D.肯定有K+、HCO3-、MnO4-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com