
题目列表(包括答案和解析)
20. (8分) SO2是硫酸工业的主要大气污染物,回收利用SO2既能减少大气污染,又能充分利用资源。已知:用Fe2+、Fe3+离子作催化剂,标况下在转化器中SO2可被O2氧化成
(8分) SO2是硫酸工业的主要大气污染物,回收利用SO2既能减少大气污染,又能充分利用资源。已知:用Fe2+、Fe3+离子作催化剂,标况下在转化器中SO2可被O2氧化成
 SO42-,实现SO2 的回收利用。某同学设计测定转化器的脱硫效率方案如下:
SO42-,实现SO2 的回收利用。某同学设计测定转化器的脱硫效率方案如下:

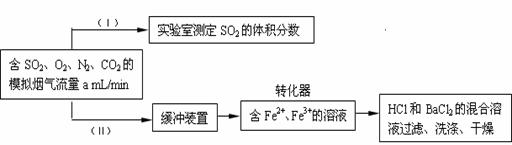

 ①在实验(Ⅰ)中,为了确定SO2的体积分数,可将模拟烟气缓慢通过已知体积和浓度的____________________
溶液,并用溶液的颜色刚好褪去时所消耗的模拟烟气的体积(标况下)来计算SO2
的体积分数。
①在实验(Ⅰ)中,为了确定SO2的体积分数,可将模拟烟气缓慢通过已知体积和浓度的____________________
溶液,并用溶液的颜色刚好褪去时所消耗的模拟烟气的体积(标况下)来计算SO2
的体积分数。
 ② 在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气流流速,还需测定的数据是______________
和
。
② 在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气流流速,还需测定的数据是______________
和
。
 (4)实验室在一定条件下,将2mol SO2(g) 和1mol O2 (g) 充入20L密闭容器中,反应从起始到平衡后压强变为原来的11/15。请计算该条件下SO2的平衡转化率及SO3(g)
(4)实验室在一定条件下,将2mol SO2(g) 和1mol O2 (g) 充入20L密闭容器中,反应从起始到平衡后压强变为原来的11/15。请计算该条件下SO2的平衡转化率及SO3(g) 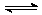 SO2(g)+1/2
O2 (g)的平衡常数,写出计算过程:
SO2(g)+1/2
O2 (g)的平衡常数,写出计算过程:






4、 以乙烯为基本原料合成3-甲基-3-戊醇(无机原料自选)
以乙烯为基本原料合成3-甲基-3-戊醇(无机原料自选)







3、
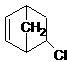
 中手性碳原子数为 个
中手性碳原子数为 个

2、 写出反应②的化学方程式
反应类型
写出反应②的化学方程式
反应类型
1、 已知A的核磁共振氢谱只有一个吸收峰,写出下列物质的结构简式
已知A的核磁共振氢谱只有一个吸收峰,写出下列物质的结构简式
 A
B
E
A
B
E

19. (12分)已知信息1:含有活泼氢的有机物与胺和甲醛发生三分子之间的缩合反应,放出水分子,称为Mannich反应。
(12分)已知信息1:含有活泼氢的有机物与胺和甲醛发生三分子之间的缩合反应,放出水分子,称为Mannich反应。

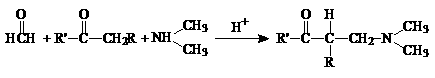


 已知信息2:
已知信息2:



 已知信息3:
已知信息3:
 ①室温下,一卤代烷(RX)与金属镁在干燥乙醚中作用,生成有机镁化合物:
①室温下,一卤代烷(RX)与金属镁在干燥乙醚中作用,生成有机镁化合物:
 RX+Mg
RX+Mg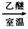 RMgX,这种产物叫格氏试剂。它可以与醛、酮、酯发生反应,可用来合成烷烃、烯烃、醇、醛、酮、羧酸等一系列化合物。如:
RMgX,这种产物叫格氏试剂。它可以与醛、酮、酯发生反应,可用来合成烷烃、烯烃、醇、醛、酮、羧酸等一系列化合物。如: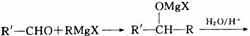
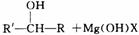

 某种抗痉挛药物E的合成路线如下:
某种抗痉挛药物E的合成路线如下:
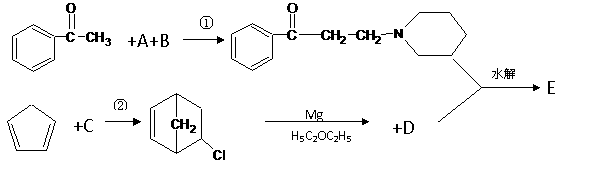








 上述反应部分产物已略去,根据所给信息,回答下列问题
上述反应部分产物已略去,根据所给信息,回答下列问题
18. (10分)已知金属镁与氯化铁和氯化铜溶液反应有多种实验假设。甲、乙两位同学分别设计合理实验步骤探究该反应的历程。
(10分)已知金属镁与氯化铁和氯化铜溶液反应有多种实验假设。甲、乙两位同学分别设计合理实验步骤探究该反应的历程。
 提出猜想:
提出猜想:
 甲:推测镁与氯化铁、氯化铜水解产生中的H+反应,拉动水解平衡生成生成H2。
甲:推测镁与氯化铁、氯化铜水解产生中的H+反应,拉动水解平衡生成生成H2。
 乙:推测镁应与氯化铁、氯化铜发生氧化还原反应。
乙:推测镁应与氯化铁、氯化铜发生氧化还原反应。
 结合对试剂的选择两位同学做了如下实验:
结合对试剂的选择两位同学做了如下实验:
 实验过程
实验过程
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
将打磨过的镁条取加入经盐酸酸化的饱和氯化铁溶液,充分反应 |
始终有大量气泡,颜色无明显变化,未见沉淀生成反应完全后取出镁条发现可被磁铁吸引 |
|
② |
将打磨过的镁条取加入0.1mol/L氯化铁溶液,充分反应 |
有少量气泡,颜色变浅,有红褐色沉淀生成,反应完全后取出镁条发现不能被磁铁吸引 |
根据实验操作,实验现象,甲、乙分别推测解释相应的结论。
 (1)写出生成Fe(OH)3胶体的离子方程式:
(1)写出生成Fe(OH)3胶体的离子方程式:
 (2)与甲同学的推测不尽符合的现象是 ,
(2)与甲同学的推测不尽符合的现象是 ,
 在实验①③的基础上甲进一步提出猜测:镁与H+反应拉动饱和氯化铁的水解平衡生成Fe(OH)3胶体,故未看到沉淀现象。
在实验①③的基础上甲进一步提出猜测:镁与H+反应拉动饱和氯化铁的水解平衡生成Fe(OH)3胶体,故未看到沉淀现象。
 要验证甲的进一步猜想,还须补做的实验是
要验证甲的进一步猜想,还须补做的实验是
 提出你的猜想
提出你的猜想
 (3)乙:根据实验②可推测
(3)乙:根据实验②可推测
 (4)结合甲,乙两位同学的推测,你能否谈谈对上述实验事实的认识:
(4)结合甲,乙两位同学的推测,你能否谈谈对上述实验事实的认识:

17. (10分)工业制硫酸生产流程如下图:
(10分)工业制硫酸生产流程如下图:

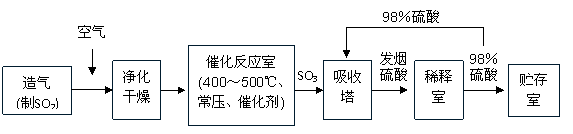

 (1)在气体进入催化反应室前,需净化的原因是:________________________________。
(1)在气体进入催化反应室前,需净化的原因是:________________________________。
 (2)在制气过程中,我国往往以黄铁矿为原料制SO2
,其铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
(2)在制气过程中,我国往往以黄铁矿为原料制SO2
,其铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
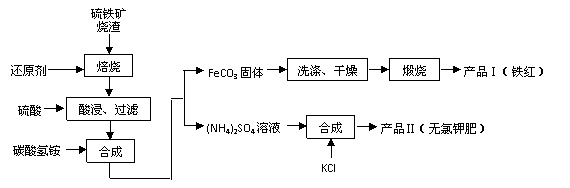








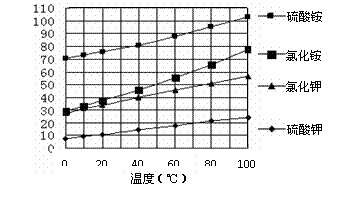 已知几种盐的溶解度随温度变化的曲线如下图所示:
已知几种盐的溶解度随温度变化的曲线如下图所示:






 则:
则:
 ①酸浸、过滤后滤液中的金属阳离子是________________。
①酸浸、过滤后滤液中的金属阳离子是________________。
 ②煅烧FeCO3生成产品Ⅰ的化学反应方程式为_______________________________ _。
②煅烧FeCO3生成产品Ⅰ的化学反应方程式为_______________________________ _。
 ③产品Ⅱ的化学式为_______________
③产品Ⅱ的化学式为_______________
 ④检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
④检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,

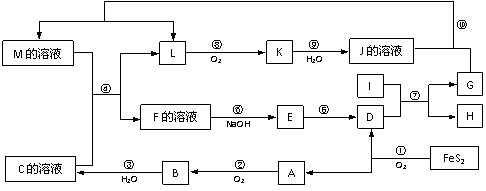
16. (10分)下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,A是具有刺激性气味的气体,I是由地壳中含量最高的金属元素形成的单质,K是一种红棕色气体,D是一种红棕色粉末,常用作红色油漆和涂料。
(10分)下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,A是具有刺激性气味的气体,I是由地壳中含量最高的金属元素形成的单质,K是一种红棕色气体,D是一种红棕色粉末,常用作红色油漆和涂料。










 请填写下列空白:
请填写下列空白:
 ⑴在周期表中,组成单质G的元素位于第______周期______族。
⑴在周期表中,组成单质G的元素位于第______周期______族。
 ⑵在反应⑨中还原剂与氧化剂的物质的量之比为______________。
⑵在反应⑨中还原剂与氧化剂的物质的量之比为______________。
 ⑶在反应②、③、⑥、⑧中,既属于化合反应又属于氧化还原反应的是_________(填写序号)。
⑶在反应②、③、⑥、⑧中,既属于化合反应又属于氧化还原反应的是_________(填写序号)。
 ⑷反应④的离子方程式是:_________________________________。
⑷反应④的离子方程式是:_________________________________。
 ⑸将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4
(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:_____________________。
⑸将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4
(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:_____________________。
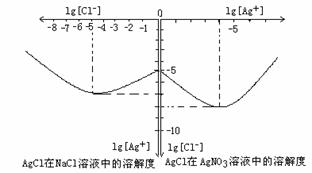
15. (10分)沉淀物并非绝对不溶,其在水及各种不同的溶液中溶解有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。下图是AgCl在NaCl、AgNO3 溶液中的溶解情况。
(10分)沉淀物并非绝对不溶,其在水及各种不同的溶液中溶解有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。下图是AgCl在NaCl、AgNO3 溶液中的溶解情况。

 由以上信息可知:
由以上信息可知:
 (1)AgCl的溶度积常数的表达式为:
,由图知AgCl的溶度积常数为
。
(1)AgCl的溶度积常数的表达式为:
,由图知AgCl的溶度积常数为
。
 (2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
 。
。
 (3)反应AgCl + KI== AgI + KCl能在水溶液中进行,是因为
。
(3)反应AgCl + KI== AgI + KCl能在水溶液中进行,是因为
。
 (4)若在AgCl形成的浊液中滴加氨水有什么现象?
(4)若在AgCl形成的浊液中滴加氨水有什么现象?
 发生反应的离子方程式为
.
发生反应的离子方程式为
.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com