
题目列表(包括答案和解析)
8、在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42-的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
A.0.225mol/L B.0.25mol/L C.0.45mol/L D.0.9mol/L
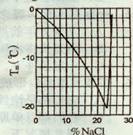
7、某些盐加入水中,可以降低水的凝固点,北美冬季常根据此原理用融雪剂消除道路上的积雪。右图是溶液凝固点随溶液中NaCl 质量百分含量变化曲线。下列叙述正确的是
A.1000 g水与150 g NaCl混合,所得溶液的凝固点是-9℃
B.只要水中的NaCl足够多,溶液凝固点就能降得足够低
C.冰块在盐水中比在自来水中融化得快
D.-12℃时,NaCl在水中的溶解度是19.0g
6、在下列溶液中,各组离子可能大量共存的是
A.使pH试纸呈红色的溶液中:Fe2+、ClO-、SO42-、Na+
B.加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、SO42-
C.由水电离出c(H+)=10-12 mol·L-1的溶液:K+、Al3+、Cl-、SO42-
 D.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
D.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
5、设NA为阿伏加德罗常数,下列叙述正确的是
A、常温下11.2L的甲烷气体含有甲烷分子数为0.5 NA
B.一定量的Fe与含1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
C.12.5 mL 16 mol/L浓硫酸与足量铜反应,转移电子数为0.2 NA
D.常温常压下,22.4L的CO2气体的物质的量为1 mol
4、Na2 FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2 O2=2Na2 FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是
A.Na2O2在反应中只作氧化剂 B.Na2FeO4既是氧化产物又是还原产物
C.O2是还原产物 D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
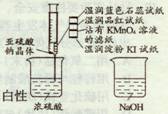
2、如图,在注射器中加入少量Na2 SO3晶体,并吸入少量浓硫酸(以不接触纸条为准),则下列有关说法正确的是
A.蓝色石蕊试纸先变红后褪色
B.NaOH溶液可用于吸收实验中多余的SO2
C.湿润淀粉KI试纸未变蓝,说明SO2的还原性弱于I2
D.品红试纸、沾有KMnO4溶液滤纸均褪色,证明了SO2的漂白性
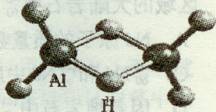 3最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高。Al 2H6球棍模型如图。下列有关说法肯定不正确的是
3最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高。Al 2H6球棍模型如图。下列有关说法肯定不正确的是
A.Al 2H6中H为+l价,Al为-3价
B.Al 2H6在空气中完全燃烧,产物为氧化铝和水
C.Al 2H6分子是非极性分子
D.氢铝化合物可能成为未来的储氢材料和火箭燃料
1、下列关于化学学习和研究的说法错误的是
A.化学模型有助于解释一些化学现象 B.质量守恒定律是大量实验事实的总结
 C.化学家提出的假设都能被实验证实 D.化学基本原理的应用是有一定条件的
C.化学家提出的假设都能被实验证实 D.化学基本原理的应用是有一定条件的
21.B.(12分)某研究性学习小组拟从实验室含碘废液中回收碘。制订两种方案提取,他们的实验方案如下:
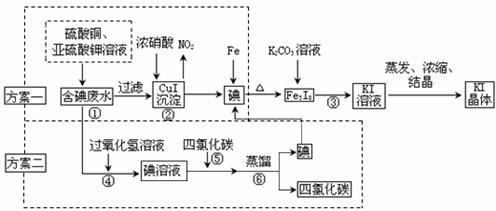
试回答下列问题
(1)方案一,说明废水含有单质碘可用的试剂是:
(2)方案一,步骤③反应的化学方程式为:
(3)方案二,用H2O2而不用Cl2,理由是:
(4)方案二,步骤⑤的名称是:
(5)方案二,蒸馏时用到的玻璃仪器,除接受器、锥形瓶、酒精灯外,还缺少的玻璃仪器有
(6)方案一,②中产生的NO2要进行循环利用,用一总反应式表示这一过程:
21.A(12分)聚合铁(简称PFS)化学式为: [Fe2(OH)n(SO4)3-n/2]m,n<5,m<10 。
 现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子。
现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子。
(l)①PFS中铁显 价,该基态铁原子的外围电子排布式是 。 ②O元素的第一电离能 N 元素的第一电离能(填“大于”或“小于”) ,
原因 ;水分子中氧原子的杂化轨道类型为 。H2O与H+以配位键结合成H3O+的立体结构为 。
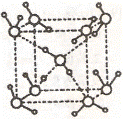
(2)水在不同的温度和压力条件下可以形成11种不同结构的晶体,密度从比水轻的0.92g/cm3扩到约为水的一倍半。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰一VII的晶体结构为一个如右上图所示的立方晶胞,每个水分子可与周围 个水分子以氢键结合,晶体中,1mol水可形成 mol氢键。
(3)2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺
(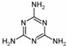 )。下列关于三聚氰胺分子的说法中正确的是 。
)。下列关于三聚氰胺分子的说法中正确的是 。
A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高
(4)已知下列元素的电负性数据:H: 2.1, O: 3.5, F:4.0。OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了
F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
20.(10分) 乙醇汽油是将乙醇和普通汽油按一定体积比混合而成,其密度与乙醇几乎相等,其中氧的质量分数为3.5%。请回答下列问题:
⑴为减少氮的氧化物排放,将燃烧汽油的汽车改为以天然气为燃料电池的电动车,电池总反应为:CH4+2O2+2KOH==K2CO3+3H2O,则该电池的负极反应为 。
⑵用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4+4NO2 = 4NO+CO2+2H2O;CH4+4NO = 2N2+CO2+2H2O
若用标况下4.48 L CH4还原NO2至N2,整个过程中转移的电子数为 。
现有1L NO2、NO混合气体NOx,将其还原成N2,需同温同压下CH4的体积0.4L,则混合气体中NO、NO2的体积比为 。
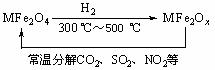 ⑶新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使汽车尾气中的酸性氧化物分解除去。转化流程如图所示:
⑶新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使汽车尾气中的酸性氧化物分解除去。转化流程如图所示:
请写出 MFe2Ox分解SO2的化学方程式 (不必配平)。
若x=3.25 则2mol MFe2Ox可分解(2)中混和气体(标况)V= L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com