
题目列表(包括答案和解析)
12.化合物 学名为邻羟基苯甲酸,俗名为水杨酸。该物质具有的性质是
①能与金属钠反应;②能和FeCl3溶液反应;③能与浓溴水作用;④在一定条件下能与氢气作用;⑤在一定条件下能与浓HNO3作用;⑥在一定条件下能与乙醇作用;
A.①②③④ B.②③④⑤ C.③④⑤⑥ D.①②③④⑤⑥
11.有Na2CO3、AgNO3、BaCl2、HCl及NH4NO3五瓶无标签溶液,为鉴别它们,取四只试管分别装入一种溶液,再向上述四只试管中加入少许剩下的一种溶液,下列结论错误的是
A.若有三只试管出现沉淀时,则最后加入的是AgNO3溶液
B.若全部没有什么变化时,则最后加入的则是NH4NO3溶液
C.若一只试管产生气体,两只试管出现沉淀时,则最后加入的是HCl溶液
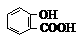 D.若只有两只试管出现沉淀时,则最后加入的是BaCl2溶液
D.若只有两只试管出现沉淀时,则最后加入的是BaCl2溶液
10.已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。对于该溶液的下列叙述中不正确的是
A.该温度高于25℃
B.c(H+)=c(OH-)+c(SO42-)
C.水电离出来的c(H+)=1×10-10mol·L-1
D.该温度下加入等体积pH为12的NaOH溶液可使反应后溶液恰好为中性
9. 已知某温度下的热化学方程式:2SO2(g)+O2(g) 2SO3(g);ΔH=-197kJ/mol,在同温同压下向密闭容器中通入2molSO2和1molO2,,达平衡时放出热量Q1kJ,向另一相同的密闭容器中通入1.5molSO2 、0.75molO2和0.5molSO3,达平衡时放出热量Q2kJ,下列关系中正确的是
已知某温度下的热化学方程式:2SO2(g)+O2(g) 2SO3(g);ΔH=-197kJ/mol,在同温同压下向密闭容器中通入2molSO2和1molO2,,达平衡时放出热量Q1kJ,向另一相同的密闭容器中通入1.5molSO2 、0.75molO2和0.5molSO3,达平衡时放出热量Q2kJ,下列关系中正确的是
A.Q1 < Q2 < 197 B. Q2< Q1< 197 C.Q1 >Q2 > 197 D.Q1 = Q2 <197
8.元素A、B、C都是短周期元素,它们的原子序数大小顺序是:A<B<C,A元素原子次外层电子数为最外层电子数的1/2,B元素原子次外层电子数是最外层电子数的2倍,B与C可形成共价化合物BC4,则下列有关说法正确的是
A.它们的单质的晶体都是分子晶体
B.它们的最高氧化物都能与水反应
C.它们的原子半径大小:r(A)>r(B)>r(C)
D.它们的简单氢化物分子中,A、B、C最外层均为8个电子
7.X、 Y、Z、M、N代表五种金属,有以下化学反应
① 水溶液中:X+Y2+=X2++Y
②Z+2H2O(冷)=Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-=M2+
④Y可以溶于稀硫酸中,M不被稀硫酸氧化,则这五种金属的活动性由弱到强的顺序是
A.N<M<Y<X<Z B.N<M<X<Y<Z C.M< N<Y<X<Z D.X<Z<N<M<Y
6.下列叙述从化学角度分析,其中不正确的是
A.由氮气为原料合成氨是氮的固定
B.向煤中加入生石灰可减少对大气的污染
C.氟里昂(CCl2F2)或NOX都可破坏臭氧层而导致温室效应
D.HgCl2的稀溶液可用于手术器械消毒,原因是HgCl2可使蛋白质变性
21.材料(选修三课本第44页实验2-2):向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
Ⅰ.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1)写出与H2O分子互为等电子体的微粒 ▲ (填2种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是 ▲ 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
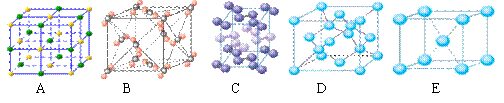
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 ▲ (请用相应的编号填写)。

Ⅱ.胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上。
(4)写出铜原子价电子层的电子排布式 ▲ ,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有 ▲ (填元素符号)。
(5)实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 ▲ 。
(6)实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是 ▲ 。
20.(8分)2006年是中国环保事业取得长足进步的一年。江南某厂平均每天产生约600 m3含氨废水(NH3 的浓度为153 mg·L-1,密度为1 g·cm-3)。该厂采用下列方法对废水进行联合处理和利用。
方法1:对废水进行加热蒸发得到NH3,使废水中的NH3 的浓度降为17 mg·L-1。
对加热蒸发得到的NH3进行合理利用:用一定量空气氧化(设空气中氧气的体积分数为20%),发生的主要反应有:
4NH3 +
5O2 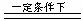 4NO + 6H2O,4NO
+ 3O2 + 2H2O === 4HNO3,
4NO + 6H2O,4NO
+ 3O2 + 2H2O === 4HNO3,
副反应有:4NH3 + 3O2 === 2N2 + 6H2O
方法2:向方法1处理过的废水中,加入甲醇,在微生物作用下发生如下反应:
2O2 + NH3 = == NO3- + H+ + H2O 6NO3- + 6H+ + 5CH3OH→ 3N2↑ + 5CO2↑ + 13H2O
若废水加热前后的体积和密度近似认为不变,试进行下列计算:
(1)方法1中,若90% NH3转化为硝酸,10% NH3发生了副反应,则消耗标准状况下的空气多少立方?
(2)方法2中,若NH3 的 转化率为95%,则消耗甲醇多少千克?
19、利胆解痉药“亮菌甲素”跟(CH3)2SO4反应可以生成A,二者的结构简式如图。
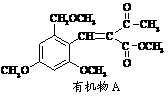
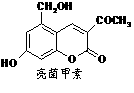
试填空。
(1)“亮菌甲素”的分子式为: ,1mol“亮菌甲素”跟浓溴水反应时最多消耗 mol Br2;
 (2)有机物A能发生如下转化,其中G分子中的碳原子在一条直线上。
(2)有机物A能发生如下转化,其中G分子中的碳原子在一条直线上。
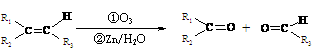
信息提示:i..
 ii.R―O―CH3
R―OH(R为脂肪烃或芳香烃的烃基)
ii.R―O―CH3
R―OH(R为脂肪烃或芳香烃的烃基)
① C→D的化学方程式是: 。
② G的结构简式是: 。
③ 同时符合下列条件的E的同分异构体有 种。
a. 遇FeCl3溶液显色;
b. 不能发生水解反应,能发生银镜反应;
c. 苯环上的一氯取代物只有一种,分子中无甲基。
写出其中任意一种的结构简式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com