
题目列表(包括答案和解析)
12.下列关于有机物的说法中,不正确的是( )
A.液化石油气和天然气的主要成分都是甲烷
B.苯、乙醇和乙酸都能发生取代反应
C.油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂
D.用新制的Cu(OH)2悬浊液可检验尿液中的葡萄糖
11.设NA代表阿伏加德罗常数的数值,下列说法中正确的是
①常温常压下,17g甲基(-14CH3)所含的中子数为9NA
②常温常压22.4L NO气体的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL 0.5mol/L 的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标况时,22.4L二氯甲烷所含有的分子数为NA
⑥常温常压下,1mol氦气含有的核外电子数为4NA
A.①② B.③④ C.②④ D.⑤⑥
10.关于下列四个图像的说法中正确的是
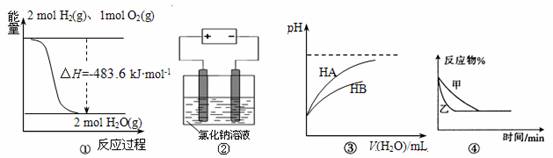
A. 图①表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ · mol-1
B.图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1∶1
C.图③表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
9.下列实验能达到预期目的的是
A.加NaOH溶液后进行分液分离乙醇和苯酚
B.测定Na2CO3、Na2SO4两溶液的pH,比较碳、硫的非金属性强弱
C.MgCl2、AlCl3溶液中分别通入NH3,比较镁、铝的金属性强弱
D.称量2.5gCuSO4·5H2O晶体溶于100 mL 水配制取0.10 mol·L-1 的硫酸铜溶液
2009.5.14
以下数据可供答题时参考:
相对原子质量:H 1 C 12 O 16 N 14 Na 23 Mg 24 Al 27 S 32 Cl35.5 Cu 64
29.(16分)用图(甲)所示的装置可进行测定 SO2 转化为SO3的转化率的实验。
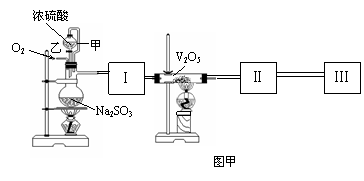 已知:SO3熔点为16.8℃。
已知:SO3熔点为16.8℃。
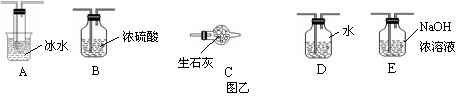
(1)根据实验的需求,Ⅰ、Ⅱ、Ⅲ应连接合适的装置。请从图乙中选择合适的装置,将其序号填入以下空格内。Ⅰ、Ⅱ、Ⅲ处所连接的装置为 、 、
(2)实验时,浓硫酸能顺利的滴入烧瓶中,甲导管所起的作用是
(3)从乙处均匀的通入氧气,为使SO2有较高的转化率,实验时,在加热与滴加浓硫酸的过程中,应采取的操作是
(4)用大火加热烧瓶时,SO2的转化率会 (填:提高、不变、降低)
(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入氧气一段时间后,称得Ⅲ装置增重bg ,则本实验中SO2的转化率为 。
28.(20分)卤代烃和金属镁在乙醚中反应生成烷基卤代镁
(RMgX),称为格林试剂,它是重要的有机合成试剂,
可与羰基化合物反应制醇,反应过程如下:
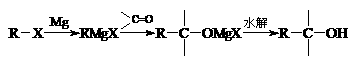

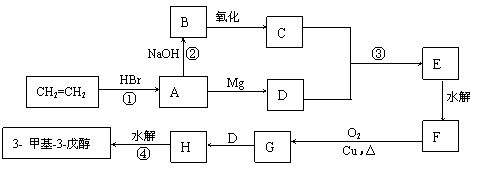 现有乙烯和必要的无机原料合成3-甲基-3-戊醇,合成路线如下:
现有乙烯和必要的无机原料合成3-甲基-3-戊醇,合成路线如下:
(1)写出下列物质的结构简式:
C ,D ,F G ,H
(2)指出①--④中属于加成反应的有
(3)F的同分导构体共有 种
(4)写出下列化学反应方程式:
A→B:
F→G:
27.(12分) (1)燃料电池作为一种新型能源,由于其电极材料丰富 、电解质多种多样(可以是固态、液态、气态等),将渗透到我们生活的各个领域。碱性燃料电池(AFC)采用30%-50%KOH溶液作电解质溶液,以氢气为燃料,在一定条件下发生反应:2H2+O2=2H2O。则该电池的电极反应式为:正极: ,负极:
此燃料电池有许多优点,其中主要有两点:首先是: ;其次是:
 (2)右图为某市售盐酸试剂瓶标签上的部分数据。
(2)右图为某市售盐酸试剂瓶标签上的部分数据。
可知:该盐酸的物质的量浓度为 ;
若取该盐酸25.4mL与2.00mol/L的氢氧化钠溶液
100mL混合,再将混合后溶液稀释至1.00L,此时溶液
的pH约为 。
26.(12分)在一定条件下可实现下列物质间的转化,丙为纯净物,C为微溶物,如图所示:

请填写下列空白:
(1)固体A是一种重要的工业原料,其化学式为:
(2)用上图中有关物质,实现C→B的转化,该转化的离子方程式为:
(3)上述变化中生成的C和丙恰好能完全反应,该反应的化学方程式为
(4)若甲和乙恰好完全反应,则W与A的物质的量之比为
(5)已知1mol乙完全燃烧放出1300kJ,写出表示乙的燃烧热的热化学方程式:
13. A、B、C三种物质各15g,发生反应A+B+C=D,反应后生成30gD。然后在残留物中加入10gA后,反应又继续开始,待反应再次停止后,反应物中只余C。根据上述推断下列说法正确的是
A.第一次反应停止B剩余9g B.第一次反应停止C后剩余6g
C.第二次反应停止C剩余5g D.反应中A和C的质量比是5∶3
非选择题:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com