
题目列表(包括答案和解析)
19.(14分)
粗盐提纯的研究。
[有关资料]
|
化学式 |
CaCO3 |
CaSO3 |
CaC2O4 |
Mg(OH)2 |
|
Ksp |
4.96×10-9 |
4.96×10-9 |
2.34×10-9 |
5.61×10-12 |
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42-的存在),该小组设计流程如下:
 [设计除杂过程]
[设计除杂过程]
(1)操作①中需要使用的玻璃仪器有 、 。操作②的名称为 ,若在操作②结束后发现溶液B略有浑浊,应采取的措施是_______ ________________
________________________________________________________________________。
(2)混合液A的主要成分是____________________。(填化学式)
[检验除杂效果]
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),看是否有沉淀生成。
步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,看是否有沉淀生成。效果最好的是 (填字母)。
A、Na2CO3 B、Na2SO3 C、Na2C2O4
[获取纯净食盐]
(4)对溶液B加热并不断滴加6 mol·L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是 。
(5)将溶液C倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到
___________ _____________时(填现象),停止加热。
[问题讨论]
(6)在除杂过程中,向粗盐悬浊液中加混合液A时需要加热,目的是 ,该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在______________以下。
18.某研究小组用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,则下列有关说法错误的是
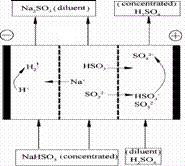 A.阳极区酸性增强
A.阳极区酸性增强
B.阴极区电极反应式为:2H++2e-=H2↑
C.diluent和concentrated的中文含义为浓缩的、稀释的
D.该过程中的副产品主要为H2SO4
17.已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0_5 |
4.9×l0_10 |
K1=4.3×l0_7 K2=5.6×l0_11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
C.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
D.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
16. 对于反应N2O4(g)
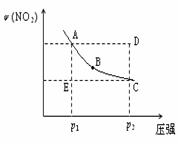
对于反应N2O4(g)
 2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
A.A、C两点的正反应速率的关系为 v(A)<v (C)
B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C.维持p1不变,E→A所需时间为x;维持p2不变,D→C 所 需时间为y,则x<y
D.使E状态从水平方向到达C状态后,再沿平衡曲线到 达A状态,从理论上来讲,可选用的条件是从p1突然加压至p2,再由p2无限缓慢降压至p1 。
15.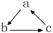 下列各组物质中,不是按
(“→”表示一步完成)关系相互转化的是
下列各组物质中,不是按
(“→”表示一步完成)关系相互转化的是
|
选项 |
A |
B |
C |
D |
|
a |
Fe |
SiO2 |
Al(OH)3 |
HNO3 |
|
b |
FeCl3 |
Na2SiO3 |
NaAlO2 |
NO |
|
c |
FeCl2 |
H2SiO3 |
Al2O3 |
NO2 |
14.几种短周期元素的原子半径及主要化合价见下表:
|
元素代号 |
K |
L |
M |
Q |
R |
T |
N |
|
原子半径/nm |
0.183 |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
0.152 |
|
主要化合价 |
+1 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
+1 |
下列叙述正确的是
A.K、L、M三元素的金属性逐渐增强
B.在RCl2分子中,各原子均满足8电子的稳定结构
C.Q元素的最高价氧化物为电解质,其水溶液能够导电
D.K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键
13.一定条件下用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 ( g )+4NO2( g ) == 4NO( g )+CO2( g )+2H2O( g ) △H=-574 kJ·mol-1
② CH4 ( g )+4NO( g ) == 2N2( g )+CO2( g )+2H2O( g ) △H=-1 160 kJ·mol一1。
下列正确的选项是
A.CH4 ( g ) + 2NO2 ( g ) == N2( g )+CO2 ( g ) + 2H2O ( l ) △H=-867 kJ·mol-1
B.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2 mol
C.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
D.若用标准状况下4.48L CH4 还原NO2至N2,整个过程中转移的电子总数为3.2 mol
12.下列各种情况下,常温下溶液中可能大量存在的离子组是
A.由水电离出的c(H+)=l×10-12mol/L的溶液中:K+、Ba2+、OH-、NO3-
B.加入铝粉能放出大量H2的溶液中:Na+、SO42-、Cl-、NH4+
C.pH=7的中性溶液中:Fe3+、Cl-、HCO3-、K+
D.使pH试纸呈红色的溶液中:K+、Fe2+、NO3-、MnO4-
11.下列离子方程式中正确的是
A.NaHSO4溶液中加Ba(OH)2溶液至中性: Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2H2O
B.NH4HCO3溶液与过量NaOH溶液反应: NH4+ + OH‑ = NH3↑+H2O
C.AlCl3溶液中滴加浓氨水至过量: Al3++4NH3·H2O = AlO2-+4NH4++2H2O
D.向硫酸亚铁的酸性溶液中滴入双氧水: 2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
10.对可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.平衡时,v正(O2)=v逆(O2)必成立
B.关系式5v正(O2)=4v正(NO)总成立
C.用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最大
D.若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com