
题目列表(包括答案和解析)
2.工业上获得有关物质的方法或途径正确的是
A.将氯气通入澄清石灰水,获得漂白粉
B.将煤进行干馏,获得焦炭、煤焦油等化工原料
C.将石油分馏,获得乙烯、丙烯及1,3-丁二烯
D.将二氧化硫通入过氧化氢溶液,获得硫酸
1.今年4月22日是第40个世界地球日。为了提高公众认识地球保障发展的意识,我省各地广泛开展了一系列活动。下列活动不符合这一宗旨的是
 A.加强海底可燃冰、锰结核的探测与开发研究
A.加强海底可燃冰、锰结核的探测与开发研究
B.积极推广风能、太阳能光伏发电
C.在生产、流通和消费等过程中实行“减量化、再利用、资源化”
D.将高能耗、高污染的企业迁至偏僻的农村地区,提高居民收入正在载入...
20(A).(化学--物质结构与性质,13分)
A、B、C、D、E五种元素,A元素的周期
数、主族数、原子序数相同;B的基态原子核
外有3种能量不同的原子轨道,且每种轨道
中的电子数相同;C元素的电离能如右图所
示;D元素的价电子构型为 ;E是第
;E是第
4周期的过渡金属元素,血红蛋白中的E元素与BD形成的配位键比与D:形成的配位键强。
E单质与BD形成的配合物E(BD)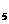 ,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。
,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。
(1)E(BD) 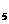 晶体属于______________(填晶体类型)。
晶体属于______________(填晶体类型)。
(2)A元素和B元素组成的化合物分子之间 ___________(填“有”或“没有”)形成氢键。
(3) 基态E原子的电子排布式为 __________________________。
(4) B、C、D三种元素的电负性由大到小的顺序是_____________________(填元素符号)。
(5)C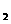 和B
和B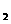 A
A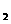 的分子中根据电子云重叠的方式不同,都包含的共价键类型有__________。
的分子中根据电子云重叠的方式不同,都包含的共价键类型有__________。
(6)已知原子数和电子数相同的微粒叫等电子体,等电子体的结构相似。根据下表数据,说明BD分子比C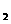 分子活泼的原因_______________________________________________
分子活泼的原因_______________________________________________
___________________________________________________________________________.
|
|
X-Y |
X=Y |
X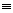 Y Y |
BD的键能(KJ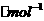 |
357.7 |
798.9 |
1071.9 |
C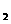 的键能(KJ 的键能(KJ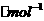 |
154.8 |
418.4 |
941.7 |
20(B).(化学--有机化学基础,13分)
有机物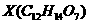 遇FeCl
遇FeCl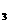 ,溶液显紫色,其部分结构简式如下
,溶液显紫色,其部分结构简式如下
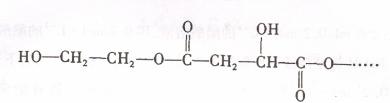
已知加热X与足量的NaOH水溶液充分反应后,经盐酸酸化得到A、B、C三种有机物,其中C分子含碳原子最多。B的核磁共振氢谱出现两组峰。A与B有如下转化关系。
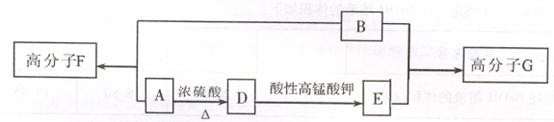
提示:RCH=CHR’在酸性高锰酸钾溶液中反应生成RCOOH和R’COOH
请回答:
(1)写出A含有的官能团的名称__________________________________.
(2)写出A-D的反应类型:_____________________________
(3)写出物质B在铜作催化剂,加热条件下与0。反应的化学方程式
_________________________________________________________________________
(4)若C烃基上一氯代物只有一种,则C的结构简式为
________________________________________________________________________
(5)1 molX与足量的NaOH水溶液充分反应,消耗NaOH的物质的量为________m01。
(6)写出高分子G的结构简______________________________________.
19.(10分)过度排放CO 会造成“温室效应”,科学家正在研究如何将CO
会造成“温室效应”,科学家正在研究如何将CO 转化为可以利用的资源,其中一种方案就是将CO
转化为可以利用的资源,其中一种方案就是将CO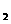 转化为可再生燃料甲醇(CH
转化为可再生燃料甲醇(CH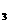 OH)。其化学方程式为:
OH)。其化学方程式为:

请填空:
(1)写出上述反应的平衡常数表达式K:______________________.
(2)在容积为2 L的密闭容器中,用一定量二氧化碳与一定量氢气在一定条件下合成甲醇,实
验结果如下图所示。下列说法正确的是(填序号)___________。
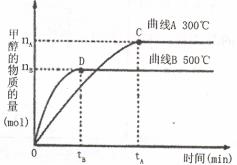
A.在300℃,从反应开始到平衡,甲醇的平均反应速率
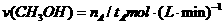
B.反应体系从300℃升温到500℃,平衡常数K变大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升温到500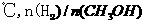 增大
增大
(3)25℃,1.01×10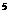 Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9 kJ热量,此反应的热化学方程式为______________________________.
Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9 kJ热量,此反应的热化学方程式为______________________________.
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极应加入或通入的物质是____________________正极的电极方程式为_________________________.
选考卷
本卷2题,各13分。考生请在20(A)、20(B)中任选一题作答。将所选题的A或B代号在选考题选择栏内的相应字母涂黑,并将答案填写在答题卡选考题的答题区域内。
18.(12分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一配制并标定醋酸溶液的浓度
取冰醋酸配制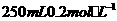 的醋酸溶液,用0.2
mol
的醋酸溶液,用0.2
mol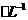 的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250mL 0.2mol.L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、_________
醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、_________
_______和______________.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol 的NaOH溶液对20.00mL醋酸溶液进
的NaOH溶液对20.00mL醋酸溶液进
行滴定,几次滴定消耗NaOH溶液的体积如下:
|
实验序号 |
1 |
2 |
3 |
4 |
|
消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为_____________。(保留小数点后四位)
实验二探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol·L |
0.0010 |
0.100 |
0.0200 |
0.1000 |
0.2000 |
|
pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
_____________________________________________________________________________________________________________________________________________________________.
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度
____________。(填增大、减小或不变)
实验三探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案________________________________
_____________________________________________________________________________________________________________________________________________________________.
17.(10分)某种施用于沙壤土的化肥主要成分由A、B、C、D四种短周期元素组成,它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素的单质在空气中的体积百分含量最高;C与D同主族;D元素原子的最外层电子数是其次外层电子数的3/4。请填空:
(1)A元素的原子结构示意图为__________________________________________
(2)D元素在元素周期表中的位置为________________________________________
(3)C和D两种元素相比较,非金属性较强的是(填元素名称)_______,可以验证该结论的证据是(填序号)__________________。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
(4)A、B、C问可形成甲、乙两种有l0个电子的离子,在加热时它们相互反应可以生成两种含10电子分子的化合物,则甲与乙反应的离子方程式为_________________________.
16.(10分)已知A、B、c是中学化学的常见物质,它们在一定条件下有如下转化关系
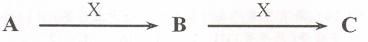
(1)若A是一种淡黄色固体,B是造成酸雨的“罪魁祸首”。则X的化学式为__________。
(2)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成;C能使湿润的蓝色石蕊试纸变红。则A与c在浓硫酸和加热条件下反应的化学方程式为___________________________________________________.
(3)若A、B、c的焰色反应均为黄色,A是一种工业原料,B俗称小苏打,电解C的水溶液可以得到两种气态产物,这两种气态产物在工业上可以合成X,则电解C的水溶液的离子方程式为__________________________。
(4)若A、C为无色溶液。B为白色胶状沉淀,是治疗胃酸过多的一种药物的主要成分,X的焰色反应为黄色,则c溶液中除氢氧根外还存在的阴离子的化学式为____________.
(5)若A、B、C均为氧化物,X是一种黑色固态非金属单质,则B分子的结构式为______.
15.在一定条件下,将3 molA和1 molB两种气体混合于固定容积为2 L的密闭容器中,发生如下反应: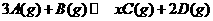 。 2
min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L
。 2
min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L 下列判断正确的是
下列判断正确的是
A.平衡常数约为0.3
B.B的转化率为60%
C.A的平均反应速率为0.3mol·(L·min)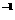
D.若混合气体的密度不变则表明该反应达到平衡状态
第Ⅱ卷
(本卷4题。共42分)
14.奥运会上发令枪所用“火药’’的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:
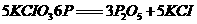 。下列有关该反应的叙述,正确的是
。下列有关该反应的叙述,正确的是
A.反应中红磷是氧化剂
B.发令时产生的白烟只有KCl固体颗粒
C.“火药”中的红磷可用白磷代替
D.反应中消耗3 mol P时,转移电子的物质的量为15 mol
13.下列说法错误的是
A.可用水鉴别苯、四氯化碳、乙醇三种无色液体
B.取1 gNaOH固体于烧杯,加入9 mL水(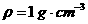 )充分搅拌配成10%的NaOH溶液
)充分搅拌配成10%的NaOH溶液
C.用NaOH溶液就可鉴别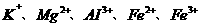 五种离子
五种离子
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com