
题目列表(包括答案和解析)
12.下列离子方程式书写正确的是
 A.等浓度等体积的NaHCO3与NaAlO2两溶液混合:H++AlO2-+ H2O = Al(OH)3↓
A.等浓度等体积的NaHCO3与NaAlO2两溶液混合:H++AlO2-+ H2O = Al(OH)3↓
B.用两个铜电极电解稀盐酸:2H+ +2Cl- H2 ↑+ Cl2↑
C.次氯酸钠漂液中加浓盐酸产生氯气:ClO- + Cl-+2H+=Cl2↑+H2O
D.用SO2还原含Cr2O72-的酸性废水:Cr2O72- + 3SO2 + 2H+ = 2Cr3+ + 3SO42-+ H2O
正在载入...
11.BaCl2·2H2O 和(CH3COO)2Ba·H2O均是重要的媒染剂。下列有关说法正确的是
A.乙酸钡溶液中离子浓度从大到小的顺序为:c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+)
B.乙酸钡溶液中:2c(Ba2+)= c(CH3COO-)+c(CH3COOH)
C.若乙酸钡和氯化钡两种溶液中c(Cl-) =c(CH3COO-),则这两种溶液中钡离子浓度也相同
D.相同浓度、相同体积的盐酸和醋酸溶液用相同浓度Ba(OH)2溶液滴定,至pH=7时消耗
Ba(OH)2溶液的体积前者等于后者
10.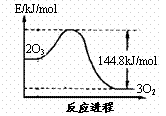 O3是重要的氧化剂和水处理剂,在平流层存在:2O3
O3是重要的氧化剂和水处理剂,在平流层存在:2O3 3O2,2O3
3O2,2O3 O+O2。粒子X能加速O3的分解:X + O3 = XO + O2;XO + O = X + O2(X=Cl、Br、NO、OH等)。已知:2O3(g)
O+O2。粒子X能加速O3的分解:X + O3 = XO + O2;XO + O = X + O2(X=Cl、Br、NO、OH等)。已知:2O3(g)
 3O2(g)
3O2(g)
△H=-144.8kJ/mol,t℃时K=3×1076。下列说法不正确的是
A.臭氧层中氟里昂释放出的氯原子是O3分解的催化剂
B.高压放电条件下O2可以生成O3
C.O3转变为O2能量曲线可用右图表示
D.t℃时,3O2(g)  2O3(g),K≈3.33×10-77
2O3(g),K≈3.33×10-77
9.下列说法正确的是
A.漂白粉必须闭封保存
B.金属钠着火可用液态二氧化碳灭火器扑灭
C.除去FeCl2中少量的FeBr2,加入适量氯水,再加四氯化碳萃取分液
D.配制硫酸亚铁溶液时,需将FeSO4·7H2O先溶于硝酸再用蒸馏水稀释,最后加少量铁粉
8.在下列溶液中,一定能够大量共存的离子组是
A.加入苯酚显紫色的溶液:Na+、Mg2+、Cl-、SO42-
B.加入金属铝能放出大量H2的溶液:NH4+、K+、HCO3-、CH3COO-
C.使淀粉碘化钾试纸变蓝的溶液: Cu2+、Ba2+、S2-、I-
D.加入金属铁能放出大量H2的溶液:Na+、Al3+、ClO-、NO3-
7.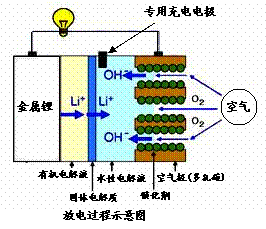 日本产业技术综合研究所最近研发了一种新型的锂空气电池,它既可用作充电电池又可作锂燃料电池。用作燃料电池时,可更换正极的水性电解液和卡盒以及负极的金属锂就可以连续使用,分离出的氢氧化锂可回收锂而循环使用。下列叙述不正确的是
日本产业技术综合研究所最近研发了一种新型的锂空气电池,它既可用作充电电池又可作锂燃料电池。用作燃料电池时,可更换正极的水性电解液和卡盒以及负极的金属锂就可以连续使用,分离出的氢氧化锂可回收锂而循环使用。下列叙述不正确的是
A.放电时负极的电极反应式为:Li-e- = Li+
B.充电时,阳极的电极反应式为:2H2O+O2+4e-=4OH―
C.充电时,锂极与外电源的负极相连
D.熔融的氢氧化锂用惰性电极电解再生时,在阴极可得到金属锂
6.
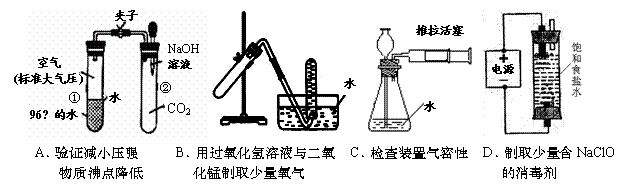 下列实验设计,不合理的是
下列实验设计,不合理的是
正在载入...
5.某高校化学工作者创建了“元素立体周期律”,在原来二维周期表横列(X轴)和纵列(Y轴)基础上,增加了一个竖列(Z轴)。Z轴按“中质差”(中子数和质子数之差△Z=N-P)自上而下,递增顺序排列。原“二维元素表”中的相对原子质量由同位素 “中质和”(中子数和质子数之和A=N+P)替代。下列说法正确的是
A.“中质和”相同的核素一定是同一元素
B.“中质差”相同的核素一定是同一元素
C.N 2 -P 2 = A×△Z
D.至2008年,人们发现108种元素有m种同位素,说明中质差一定有m种
4.下列实验过程中出现的异常情况,其可能原因分析错误的是
|
选项 |
异常情况 |
可能原因分析 |
|
A |
蒸发结晶:蒸发皿破裂 |
将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部 |
|
B |
分液:分液漏斗中的液体难以滴下 |
没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
|
C |
萃取:液体静置不分层 |
加入萃取剂的量较多 |
|
D |
蒸馏:冷凝管破裂 |
冷凝管没有通水或先加热后通水 |
3.用NA表示阿伏加德罗常数的值。下列叙述正确的是
 A.常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移
A.常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移
4NA个电子
B.23g钠与一定量的氧气作用,若两者均无剩余,转移NA个电子
C.1mol/L(NH4)2SO4溶液中,含SO42-NA个,NH4+少于2NA个
D.0.5mol雄黄(As4S4,结构如右图)含有NA个S-S键正在载入...
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com