
题目列表(包括答案和解析)
5.下列实验操作或对实验事实的描述中正确的说法共有( )
①燃着的酒精灯不慎碰翻失火,可立即用湿布盖灭
②滴定用的锥形瓶和滴定管都要用所盛溶液润洗
③分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
④配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
⑤不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
⑥用托盘天平称量时,所称药品均可放在纸上,并置于天平的左盘
⑦测定溶液的pH时,可用洁净、干燥的玻璃棒蘸取溶液,滴在pH试纸上,再与标准比色卡比较
⑧浓硝酸与浓盐酸均易挥发,故均应保存在棕色试剂瓶中,并置于阴凉处
⑨配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液的浓度偏高
⑩可以用酸式滴定管量取20.00mL0.1000mol·L-1KMnO4溶液
A.4个 B.5个 C.6个 D.7个
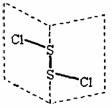 6.二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是
6.二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是
A.S2Cl2的电子式为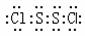
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:
2S2Cl2+2H2O=SO2↑+3S↓+4HCl
4.分析推理是化学学习方法之一。下列实验推理中,正确的是
A.金属的冶炼方法与金属的活泼性有很大的关系,所以银和汞可以用热分解的方法冶炼
B.某雨水的pH小于5.6,说明雨水中一定溶解了SO2
C.糖尿病人应少吃含糖的食品,某八宝粥中注明未加糖,所以糖尿病人可以放心食用
D.将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明镁比铝活泼
3.下列各组离子可能大量共存的是
A.不能使酚酞试液变红的无色溶液中:Na+、CO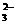 、K+、ClO-、AlO
、K+、ClO-、AlO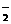
B.能与金属铝反应放出氢气的溶液中: K+、NO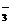 、Cl-、NH
、Cl-、NH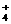
C.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO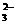
D.中性透明溶液:K+、HCO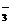 、NO
、NO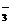 、Fe3+、SO42-
、Fe3+、SO42-
2. 下列表示物质的化学用语正确的是
A.NH4H的电子式: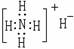 B.硝基苯的结构简式:
B.硝基苯的结构简式: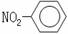
C.葡萄糖的实验式:CH2O D.甲烷分子的比例模型: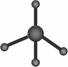
1.《新科学家》网站报道,科学家通过电解Fe2O3-SiO2-CaO的熔融液(1600℃)制得了铁和氧气。与常规方法比,将该方法用于工业上大规模冶铁,以下优点分析错误的是
A.副产工业用氧 B.大幅度降低能耗
C.大幅度降低温室气体的排放 D.制得更纯的铁
8.现有物质A-I,其转化关系如下图,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(反应中生成的其它物质已略去)
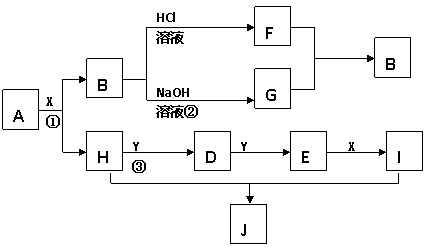
根据上述转化关系图回答:
(1)写出下列物质的化学式X:___________J:_____________
(2)物质H的电子式______________,物质J中的化学键类型有______________
(3)写出反应①的化学方程式__________________________________,
写出反应②的离子方程式___________________________________,
写出反应③的化学方程式____________________________________。

7.如下图所示的物质的相互转变中,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应。常温下,D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%。

请回答下列问题:
(1)写出F的化学式: ;
(2)写出G的电子式: ;
(3)反应①的化学方程式为 ;
人们将反应①所涉及的化学工业称为 ;
(4)反应⑤的离子方程式为 ;
高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为
①Na2FeO4具有强氧化性可杀菌消毒,② 
6.下列框图中的每一个字母都是中学化学中常见的物质,所有物质均由短周期元素组成,其中B、C、G、K、L都含有同一种元素。B、E、F、I为单质。常温常压下D为液体,E、F、I为气体,F是空气的主要成分之一。C由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。这些物质之间有可能发生如下转化,其反应关系如图所示:
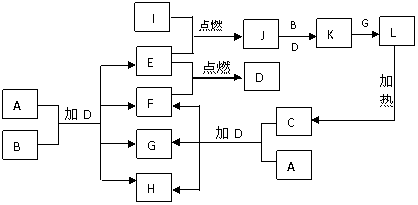
(1) 写出E+F→D的化学反应方程式___________________________________。
(2) B的化学式_______, E在I中燃烧的现象为________________________。
(3) 如上图所示,A与C两种固体混合后,加入液体D,可能发生反应的化学方程式为
 ________________________________,_________________________________。
________________________________,_________________________________。
(4)K+G L的离子方程式为____________________________________________。

4.中学化学中几种常见物质的转化关系如下:(提示:A有可变价态且与硫反应生成低价态)
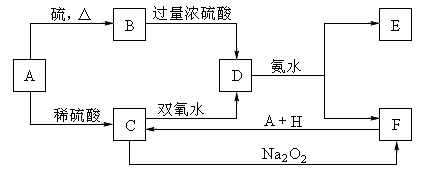
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体F粒子直径大小的范围: 。
(2)B的化学式: 。
(3)①H2O2分子的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象:
。
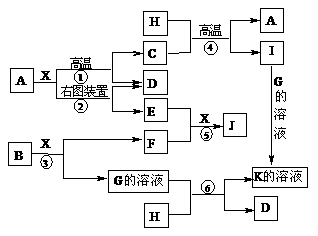
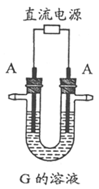 5.下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
5.下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
请按要求填空:
⑴写出B的电子式:____________________。
⑵反应⑤的现象是_____________________________________________。
⑶反应①的化学反应方程式是________________________________________,
在实验室引发反应④的操作是____________________________________。
⑷反应⑥的离子方程式是_________________________________________。
3.A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第_______周期、第_______族 ;
(2)写出反应①的化学方程式___________ _________;
(3)写出反应④的离子方程式_____________ _______;
(4)写出反应③的电极方程式:
阳极:_______________ _____ 阴极:____________ __________
(5)从能量变化的角度看,①②③反应中属于△H<0的反应是___________。(填序号)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com