
题目列表(包括答案和解析)
16.(12分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3 + 24NaOH
+7KClO3 12Na2CrO4 + 3Fe2O3 +7KCl + 12H2O,
12Na2CrO4 + 3Fe2O3 +7KCl + 12H2O,
试回答下列问题
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
。
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式: 。
(3)操作③的目的是什么,用简要的文字说明: 。
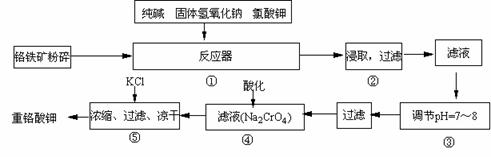
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
。
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是: ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应) 。
15.(10分) 为了测定氢氧化钠固体混合物m g中碳酸钠的质量分数,甲、乙两位同学分别设计了如下的实验方案:
(I)甲同学的方案是:将样品溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称量得固体n g。
(1)混合物中碳酸钠的质量分数为(用m、n表示) 。
 (2)甲同学洗涤沉淀的操作是
。
(2)甲同学洗涤沉淀的操作是
。
(3)Ca2+、Ba2+ 都可以使CO32-沉淀完全,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是:
① ;
② ;
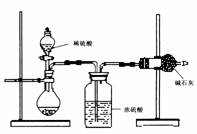
(II)乙同学的方案如图所示:
(1)根据乙同学的实验装置图分析,在每次实验中,完成测定过程至少要进行 次称量操作。
(2)他重复正确操作了三次,结果数据出现了较大的偏差,你认为主要原因可能是(任写三个):① ;
② ;
③ 。
14.现有下列四个图像:
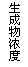
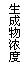
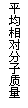
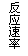
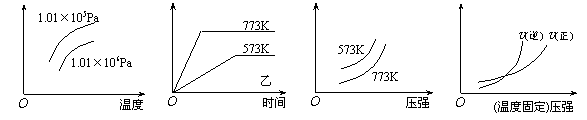
下列反应中全部符合上述图像的反应是
A.N2(g)+3H2(g)  2NH3(g);△H=-Q1kJ/mol(Q1>0)
2NH3(g);△H=-Q1kJ/mol(Q1>0)
B.2SO3(g) 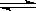 2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0)
2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0)
C.4NH3(g)+5O2(g) 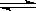 4NO+6H2O(g);△H=-808.7
kJ/mol
4NO+6H2O(g);△H=-808.7
kJ/mol
D.C(s)+CO2(g) 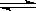 2CO(g);△H=+171.4kJ/mol
2CO(g);△H=+171.4kJ/mol
13.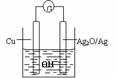 普通水泥在固化过程中自由水分子减少并产生,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是
普通水泥在固化过程中自由水分子减少并产生,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是
A.工业上以黏土、石灰石为主要原料来制造水泥
B.测量原理示意图中,Ag2O为负极
C.负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O
D.电池工作时,OH-向正极移动
12.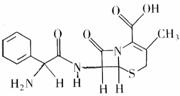 头孢拉定片(Cefradine Tablets),又称先锋,该药品适宜敏感菌所导致的急性咽炎,扁桃体炎,中耳炎等呼吸道感染。其结构式如图所示,有关该物质的描述正确的是( )
头孢拉定片(Cefradine Tablets),又称先锋,该药品适宜敏感菌所导致的急性咽炎,扁桃体炎,中耳炎等呼吸道感染。其结构式如图所示,有关该物质的描述正确的是( )
A、分子式为C16H20N3O4S
B、该物质在一定条件下能发生水解
C、该有机物质属于芳香族化合物
D、该物质能与NaHCO3溶液反应放出CO2
11.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A、0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c (OH-) B、0.1mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-)
C、0.1mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D、c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c( NH4Cl)
10.“XYn”表示不同卤素之间靠共用电子对形成的卤素互化物 (非金属性:X<Y), 其化学性质和卤素单质相似。下列说法中,正确的是
A.ICl与水反应可生成 HCl 和 HIO,则1mol ICI 参加反应转移电子为 1mol
B.某温度,液态 IF5电离:2IF5≒ IF4+ +IF6-, 则 c (IF4+)×c (IF6-) 是一个常数
C.BrCl与 Zn 反应生成 ZnCl2 和 ZnBr2
D.XYn 与卤素单质一样都是非极性分子
9.下列离子方程式书写正确的是
A.氨水吸收少量的二氧化硫:NH3·H2O + SO2 = NH4+ + HSO3-
B.用两个铜片作电极电解盐酸:Cu + 2H+  H2↑+ Cu2+
H2↑+ Cu2+
C.用石墨作电极电解AlCl3溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.Na2O2加入到足量H218O中:2Na2O2+2H218O = 4Na++4OH-+18O2↑
8.设NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下,1L液态水中含有的H+ 数目10-7NA
B.足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数为2NA
C.常温常压下,含有NA 个NO2分子的气体质量为4.6g
D.14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为NA/n
7.用下列四种装置制备和收集Cl2:
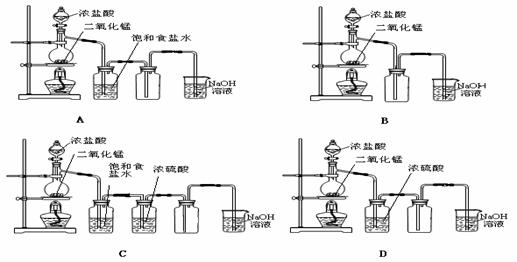
将收集到Cl2置于天平上称量,若四个集气瓶体积相同、质量相等,则称量结果是
A.A最重 B.B最重 C.C最重 D.D最重
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com