
题目列表(包括答案和解析)
5.下列化学式中只能表示一种物质的是( )
A.C3H7Cl B.CH2Cl2 C.C2H6O D.C2H4O2
答案B解析:A可表示两种物质:CH2ClCH2CH3(1-氯丙烷)与CH3CHClCH3(2-氯丙烷);C可表示:CH3OCH3(二甲醚)与CH3CH2OH(乙醇);D可表示:CH3COOH(乙酸)与HCOOCH3(乙酸甲酯)。
4.有A、B两种烃,含碳元素的质量分数相等,下列关于A和B的叙述正确的是( )
A. A和B一定是同分异构体 B. A和B不可能是同系物
C. A和B实验式一定相同
D. A和B各1 mol完全燃烧后生成的CO2的质量一定相等
答案 C 解析:烃只有C、H两种元素,含碳元素的质量分数相等,则含氢元素的质量分数也相等,具有相同的实验式。
3. 可以用分液漏斗分离的一组液体混合物是( )
A.溴和四氯化碳 B.苯和溴苯 C.水和硝基苯 D.苯和汽油
答案C 解析:分液漏斗分离的液体混合物应是互不相溶、易分层的液体混合物。
2. 已知丙烷的二氯代物有四种异构体,则其六氯代物的异构体数目为( )
A 两种 B 三种 C 四种 D五种
答案C 解析:采用换元法,将氯原子代替氢原子,氢原子代替氯原子,从二氯代物有四种同分异构体,就可得到六氯代物也有四种同分异构体。注意解决此类问题的规律:设烃的分子式为CxHy,如果它的m氯代物与n氯代物的同分异构体数目相等,则m+n=y,反之,如果m+n=y,也可知道其同分异构体数目相等。
1.下列物质属于有机物的是 ( )
A.Na2CO3 B. CaC2 C. CO(NH2)2 D. CO
答案 C.解析:有机物是指绝大多数含碳的化合物,而碳的氧化物、碳酸与碳酸盐由于其性质与有机物的性质差异较大,一般把它们归为无机物。
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
21.(A)[物质结构与性质]等电子体原理是指两个或两个以上的分子(或离子),它们的原子数相同,分子(或离子)中价电子数也相同,这些分子(或离子)常具有相似的电子结构,相似的几何构型,而且有时在性质上也有许多相似之处。
(1)SiO32-、SO32-、NO3-三种离子是等电子体,三种离子的几何构型为__________,其中Si、S、N三种基态原子的第一电离能大小关系为_____________________。
(2)C2O42-和 是等电子体,C2O42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色,Mn原子在元素同期表中的位置是__________,外围电子构型为__________。
(3)二原子14电子的等电子体共同特点是物质中都具有共价叁键,请举出相应的3个例子____________________(可以是分子或离子)。每个分子或离子中含_____个σ键,______个π键。
(4)过去生产上常以SiO2为催化剂的载体,它和近十几年来应用日广的AlPO4是等电子体,在AlPO4中 P为 配位氧。SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞,则一个硅的晶胞中有________个Si原子。再在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有_______个Si原子,______个O原子。
21B.[实验化学]如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验。
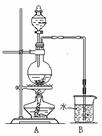
(1)A装置中发生化学反应的离子方程式为___________________________________。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
①提出假设
假设一 ________________________________________。
假设二________________________________________。
假设三_________________________________________。
假设四 H2O使布条褪色
②设计实验方案
基于提出的假设,设计出实验方案(不需要作答)
③实验过程
实验①:______________________________________________;
实验②:______________________________________________。
实验③:把红色布条放在水里,布条不褪色。
④得出结论 _______________________________________________________。
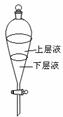
(3)用量筒取20mL氯水,倒入已检查完好的分液漏斗中,然后再注入10mL CCl4,盖好玻璃塞,振荡,静置于铁架台上(如图),等分层后取上层液和下层液,呈黄绿色的是_______________(填“上层液”或“下层液”),再装入如图所示的烧杯中,能使有色布条褪色的是__________(填“上层液”或“下层液”)

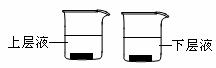
(4)这套装置的缺点是______________________,如何改进,画出改进的实验装置图。
20.二甲醚(CH3OCH3)是一种新型的合成“柴油”。它可由生物甲烷或天然气合成。
 (1)生物甲烷是由植物和动物粪便在一定条件下发酵而得的甲烷:
(1)生物甲烷是由植物和动物粪便在一定条件下发酵而得的甲烷:
(C6H10O5)n+nH2O 3nCH4↑+3nCO2↑,若某植物纤维素(C6H10O5)n的含量为10%,某沼气池,当加入该植物162kg,在微生物作用下完全转化可得CH4在标准状况下的体积为__________________m3。
(2)合成二甲醚主要步骤为造气和合成。过程如下:
|
|

若造气时,设每步转化率均为100%,设某天然气中只含5%CO2,不含其它杂质,每100m3天然气,应同时通入水蒸气和空气各多少体积(空气只含N2和O2且体积比为4:1,下同),才能保证合成时CO和H2充分利用。V[H2O(g)]=________m3;V(空气)=_________m3。
(3)为了充分利用反应过程中生成的比较纯净的氮气,某企业用天然气为主要原料联合生产二甲醚和氨,过程如下:
制气设备:①CH4+H2O→CO+3H2 ②2CH4+O2→2CO+4H2
合成塔I:CO+2H2→CH3OH,2CH3OH→CH3OCH3+H2O;
合成塔II:N2+3H2  2NH3
2NH3
假设天然气中只含CH4,反应②中通入适量空气,通过调节①和②中投入的CH4的量,以使反应①剩余的H2和反应②剩余的N2的体积比恰为3:1,以便合成氨。该企业每生产34tNH3理论上同时可以得到二甲醚多少吨(设工业经多次转化,总转化率假定为100%,设合成塔I中水与CO不反应)?
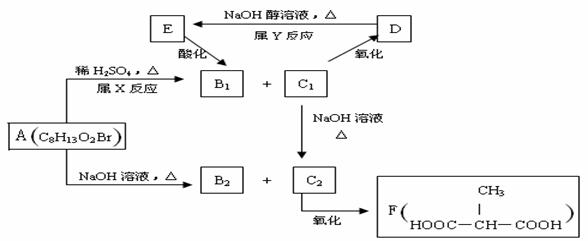
19.(12分)Ⅰ.某化合物A在一定条件下能发生如下图所示的转变:
其中只有B1既能使溴水褪色,又能与Na2CO3 溶液反应放出CO2 ,回答下列问题:
(1)指出反应类型:X 反应,Y 反应。
(2)物质A的结构简式为 。
(3)写出C1 
 C2的化学方程式
。
C2的化学方程式
。
(4)与F互为同分异构体且核磁共振氢谱只有一种峰的有机物的结构简式有 。
Ⅱ.已知,卤代烃之间能发生反应:
C4H9Cl
 (C4H9)2CuLi
(C4H9)2CuLi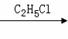 C4H9-C2H5
C4H9-C2H5
聚苯乙烯是一种生活中常见的塑料,试以碳化钙、苯为基本有机原料,无机原料自选,在下列方框中用合成反应流程图合成聚苯乙烯
流程图示例:A 
 B
B
18.(10分)甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g) CH3OH(g) ΔH
< 0。
CH3OH(g) ΔH
< 0。
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡。
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是 _______(填字母)。
A.升高温度 B.增大压强 C.通入CO D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡____________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的理由是________________________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
|
CO2%-CO%-H2% (体积分数) |
0–30–70 |
2–28–70 |
4–26–70 |
8–22–70 |
20–10–70 |
|||||||||||
|
反应温度/℃ |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
|
|
碳转化率(%) |
CH3OH |
4.9 |
8.8 |
11.0 |
36.5 |
50.7 |
68.3 |
19.0 |
33.1 |
56.5 |
17.7 |
33.4 |
54.4 |
8.0 |
12.0 |
22.6 |
|
CH4 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2.8 |
2.8 |
2.8 |
(3)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________。
结论二:_____________________________________________
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验。
|
组别 |
体积分数(%) |
|||
|
CO |
CO2 |
H2 |
N2 |
|
|
第1组 |
19.7 |
0.0 |
59.1 |
21.2 |
|
第2组 |
20.7 |
0.3 |
62.1 |
16.9 |
|
第3组 |
16.9 |
1.3 |
50.7 |
31.1 |
|
第4组 |
19.8 |
5.5 |
59.4 |
15.3 |
|
第5组 |
20.3 |
10.9 |
60.9 |
7.9 |
进行该验证实验时,控制不变的因素有________________、_________________、____________________________________________等。
17.(8分) 下图是一些常见物质间的转化关系图,图中所有物质含有的元素中只有一种不是短周期元素,所有反应物、生成物及溶液中的水均未标出,反应②中还有3种产物未标出,x是室内装潢材料中产生的主要有害气体之一,G是由四种元素组成的强碱。
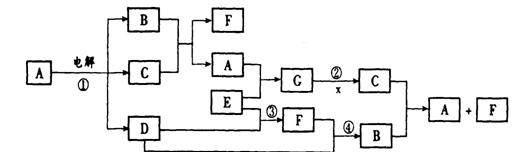
回答下列问题:
(1)写出下列物质的化学式:B 、C ;
(2)列举两种能氧化x的物质(单质、化合物各一种) 、 ;
(3)写出反应①②的离子方程式:
①
② 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com