
题目列表(包括答案和解析)
7.在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取
C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大
D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
6.下列离子方程式书写正确的是
A.AgCl悬浊液中加入硫化钠饱和溶液:2AgCl + S2-= Ag2S +2Cl-
B.含等物质的量的硫酸氢钠与氢氧化钡两溶液混合:
2H+ +2OH- + Ba2+ +SO42- = BaSO4 ↓ +2H2O
C.向Ca(ClO)2溶液中通入少量的二氧化硫:
Ca2+ +2ClO-+SO2+H2O = CaSO3¯ +2HClO
D.用FeS除去工业废水中的Hg2+:Hg2++S2-= HgS↓
5.下列反应不可用于设计原电池的是
A.NaOH + HCl = NaCl + H2O B.2CH3OH + 3O2 → 2CO2 + 4H2O
C.Zn +2HCl ==== ZnCl2 + H2 D.4Al + 3O2 + 6H2O ==== 4Al(OH)3
4.下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱性溶液中:Na+、K+、AlO2-、CO32-
C.常温下在c(H+)=10-13 mol·L-1的溶液中:NH4+、Al3+、SO42- 、NO3-
D.常温下在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
3.设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,1 L液态水中含有的H+ 数目大于10-7NA
B.14 g链烃(分子通式为CnH2n)中含有的C=C的数目一定为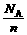
C.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA
D.1 mol FeCl3完全水解生成NA个胶体粒子
2.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,一般不需要使用玻璃棒进行操作的是
① 用pH试纸测定Na 2CO3溶液的pH
② 将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
③ 从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
④ 探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤ 用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
⑥ 用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
⑦ 实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
A.②③⑦ B.②⑤⑦ C.②④⑤ D.②④⑥
1.2008年9月开始陆续有多个品牌的奶粉被检出含有危害人体的三聚氰胺,这就是轰动全国的问题奶粉事件。三聚氰胺的制备反应为:
6CO(NH2)2[尿素]硅胶380~400℃C3N6H6+ 6NH3+3CO2
三聚氰胺和甲醛在一定条件下反应制备三聚氰胺甲醛树脂:
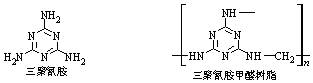
下列说法中不正确的是
A.三聚氰胺与盐酸和硫酸等都能形成三聚氰胺盐
B.三聚氰胺含氮的质量分数高于尿素和甘氨酸
C.三聚氰胺分子中所有的氮原子的化学环境均相同
D.三聚氰胺甲醛树脂是一种高分子材料
1.针对苏教版化学1第75页上“铁与氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为+2价铁的化合物,如果与氧化性较强的氧化剂(如氯气、双氧水等)反应则转化为+3价的化合物”的叙述,化学研究性学习小组拟通过以下实验探究“新制的还原性铁粉和盐酸的反应(铁过量)”。请你参与探究并回答有关问题:
(1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是 ;但在实验中往往又看到红色迅速褪去,同时溶液呈黄色,其可能的原因是 ;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出该现象产生的化学方程式: 。
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现红色褪去。同学对红色褪去的原因提出各自的假设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
(3)探究高铁酸钾的某种性质。
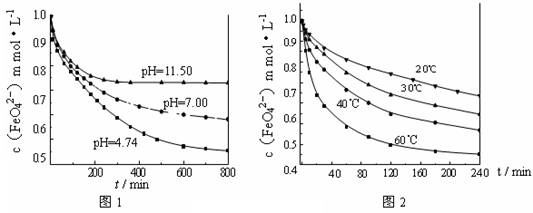 [实验1]将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L-1 =10-3 mol·L-1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
[实验1]将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L-1 =10-3 mol·L-1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
[实验2]将适量 K2FeO4 溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0 mmol·L-1 的试样,将试样分别置于 20℃、30℃、40℃和 60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为4 FeO42-+10 H2O 4
Fe(OH)3 +8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。
4
Fe(OH)3 +8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。
1.A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子。
请回答下列问题:
(1)当n=2时,AB2属于 分子(填“极性”或“非极性”),分子中有 个σ键、 个π键。A6H6分子中A原子的杂化轨道类型是 杂化。
(2)当n =3时, A与B形成的晶体属于 晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种原子的电负性由大到小的顺序是 (用元素符号表示);A、C、D三种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
 (4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O。该配合物中的中心离子钴离子在基态时的核外电子排布式为
,作为配位体之一的NH3分子的空间构型为
。
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O。该配合物中的中心离子钴离子在基态时的核外电子排布式为
,作为配位体之一的NH3分子的空间构型为
。
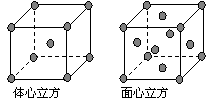
(5)金属铁的晶体在不同温度下有两种堆积方式, 晶胞分别如右图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 。
1.有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大,其中B元素是地壳中含量最多的元素。已知A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的二分之一;C、D、E三种元素的基态原子具有相同的能层数,且E原子的p能级上电子数比D原子的p能级上多一个电子;六种元素的基态原子中,F原子的电子层数最多且和A处在同一主族。
请回答下列问题:
(1)用电子式表示C和E形成化合物的过程: 。
(2)写出基态F原子的核外电子排布式: 。
(3)A原子与B原子形成A2B分子中B原子的轨道杂化类型是 ,分子的立体构型是 。
(4)A2B分子组成的晶体内,分子间作用力为 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com