
题目列表(包括答案和解析)
13.下列溶液中各微粒的浓度关系正确的是
A.常温下,将0.1 mol·L-1 NH4Cl溶液与0.05 mol·L-1 NaOH溶液等体积混合:
c (Cl-)> c (Na+)> c(NH4+)> c (OH-)> c (H+)
B.在小苏打溶液中存在:c(HCO3-)=c(Na+)-c (CO32-)-c(H2CO3)
C.向CH3COOH溶液中加入适量的NaOH,得到pH=4的混合溶液:
c(Na+) > c(CH3COO-) > c (H+)> c (OH-)
D.pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:
c(M+)=c(X-)>c(H+)=c(OH-)
12.达菲是目前被世界卫生组织推荐作为治疗和预防甲型H1N1流感病的有效药物之一,它是由我国特有中药材八角的提取物--莽草酸为原料合成的。已知莽草酸和达菲的结构简式如下:
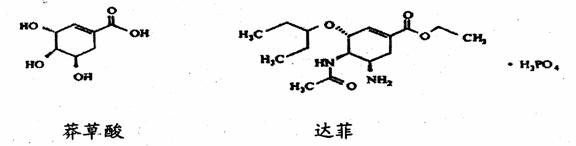
下列判断正确的是
A.莽草酸与FeCl3溶液反应显紫色
B.达菲不能使溴的四氯化碳溶液褪色
C.莽草酸在一定条件下能够发生加成、酯化、消去、氧化等反应
D.1 mol达菲与NaOH溶液反应,消耗NaOH的物质的量最多为4 mol
11.下列离子方程式书写正确的是
A.碳酸氢镁溶液中加入足量的石灰水:
Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O
B.甲醛与足量银氨溶液共热:

C.在银氨溶液中滴加过量氢碘酸:
[Ag(NH3)2]++OH―+3H++I― =AgI↓+2NH4++H2O
D.三氯化铁溶液中通入硫化氢气体:2Fe3++H2S=Fe2++S↓+2H+
10.下列实验操作或说法正确的是
A.配制银氨溶液时是将硝酸银溶液滴入到氨水中至不再生成沉淀为止
B.容量瓶和中和滴定用的锥形瓶用蒸馏水洗净后立即使用,不会对实验结果造成误差
C.检验二氧化碳气体中是否含有二氧化硫,可以将气体通入到饱和碳酸氢钠溶液中
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
9.X、Y、Z、M是4种短周期元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期。X原子最外层电子数是其电子层数的3倍。Z原子的核外电子数比X原子少1。M是同周期中半径最大的元素(除稀有气体元素外)。下列说法正确的是
A.Y元素最高价氧化物对应水化物的化学式可表示为HYO3
B.Z和M组成的化合物为离子化合物,它与盐酸反应可以生成两种盐
C.X、Y、Z元素的气态氢化物中,Y的沸点最高
D.四种元素简单离子的半径由大到小依次为Y>Z>X>M
8.下列各种溶液中,可能大量共存的离子组是
A.加入铝粉生成H2的溶液中:K+、Cu2+、SO42-、ClO-
B.室温时,由水电离的c(H+)=1×10-13mol/L溶液中:K+、Ba2+、OH-、NO3-
C. 无色透明溶液中:Fe3+、K+、Br -、SO42-
D.碳酸钠溶液中:Na+、SO42-、SiO32-、Mg2+
不定项选择题:本题包括6小题,每小题4分,共计24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
7.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O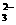 +O2+xOH-
+O2+xOH- Fe3O4+S4O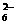 +2H2O,下列说法中正确的是
+2H2O,下列说法中正确的是
A.每生成1 mol Fe3O4,反应转移的电子总数为3 mol
B.Fe2+是还原剂,O2是氧化剂
C.1 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3 mol
D.该化学方程式可能有多组配平的化学计量数
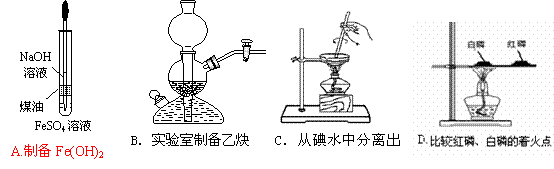
6.下列装置或操作能达到实验目的的是
5.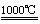 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔) 4Na +O2↑+2H2O; 后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为
4Na +O2↑+2H2O; 后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为
 3Fe + 4NaOH Fe3O4
+ 2H2↑ + 4Na↑。下列有关说法正确的是
3Fe + 4NaOH Fe3O4
+ 2H2↑ + 4Na↑。下列有关说法正确的是
A.电解熔融氢氧化钠制钠,阳极发生的电极反应为
2OH- + 2e- == H2↑ + O2↑
B.盖·吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖·吕萨克法制得等量的钠,则两反
应中转移的电子总数也相同
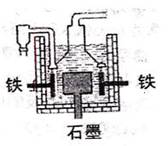
D.目前工业上常用电解熔融氯化钠法制钠(如右图),
电解槽中石墨极为阳极,铁为阴极
4.下列现象或反应原理的解释正确的是
|
|
现象或反应 |
解释 |
|
A |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
|
B |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
|
C |
镀层破损后,镀锡铁比镀锌铁易腐蚀 |
锡比锌活泼 |
|
D |
2CO=C+O2在任何条件下均不能自发进行 |
该反应的△H>0、△S<0 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com