
题目列表(包括答案和解析)
23.(11分)
重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其它钡盐。工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法。
高温煅烧还原法:
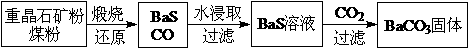
已知:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H= -1473.2 kJ·mol-1
C(s)+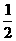 O2(g)=CO(g);△H=
-110.5
kJ·mol-1
O2(g)=CO(g);△H=
-110.5
kJ·mol-1
Ba(s)+S(s)=BaS(s);△H= -460kJ·mol-1
(1)煅烧还原的热化学方程式为: 。
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示) 。
沉淀转化法:
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32―(aq) BaCO3(s)+SO42―(aq)(平衡常数K=0.042)
BaCO3(s)+SO42―(aq)(平衡常数K=0.042)
(3)现有0.20 mol BaSO4,每次用1.00 L 2.0mol·L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是 。
22.(11分)
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH3(g);△H<0
2NH3(g);△H<0
反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
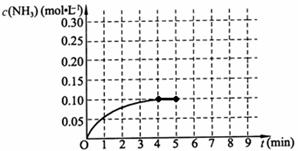
(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为 。
(2)该反应到平衡时H2的转化率 。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 。(填序号)。
a 0.20mol·L-1 b 0.12 mol·L-1
c 0.10 mol·L-1 d 0.08 mol·L-1
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡向 移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数 (填“增大”、“减少”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1 ),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
21. (12分)
(12分)
 某溶液中可能含有SO32-、SO42-、 HCO3-
三种离子中的两种或三种。为探究其组成,小明取出两份相同的样品溶液于试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氯化钡溶液,产生白色沉淀。请设计合理实验,在小明实验的基础上做进一步的实验,对小明的实验给出结论。
某溶液中可能含有SO32-、SO42-、 HCO3-
三种离子中的两种或三种。为探究其组成,小明取出两份相同的样品溶液于试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氯化钡溶液,产生白色沉淀。请设计合理实验,在小明实验的基础上做进一步的实验,对小明的实验给出结论。
 仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、酒精灯、带单孔胶塞的导管;lmol/L硫酸;2mol/L盐酸;2mol/L硝酸;lmol/L氯化钡、澄清石灰水、品红溶液、蒸馏水。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、酒精灯、带单孔胶塞的导管;lmol/L硫酸;2mol/L盐酸;2mol/L硝酸;lmol/L氯化钡、澄清石灰水、品红溶液、蒸馏水。
 完成下列探究过程:
完成下列探究过程:
 (l)提出假设:
(l)提出假设:
假设 l :溶液中存在SO32-、SO42- 假设 2 :
假设 3 : 假设 4 :溶液中存在SO32-、SO42-、 HCO3-
(2) 基于假设4 , 设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。
|
步骤编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
|
|
|
|
…… |
…… |
…… |
20. (12分)
(12分)
 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:

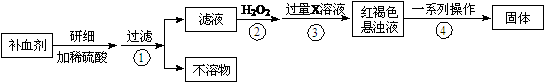 请回答下列问题:
请回答下列问题:
 (1)如何证明步骤①滤液中含有Fe2+ 。
(1)如何证明步骤①滤液中含有Fe2+ 。
 (2)步骤②加入过量H2O2的目的:
。
(2)步骤②加入过量H2O2的目的:
。
 (3)步骤③中反应的离子方程式:
。
(3)步骤③中反应的离子方程式:
。
 (4)步骤④中一系列处理的操作步骤: 、洗涤、灼烧、 、称量。
(4)步骤④中一系列处理的操作步骤: 、洗涤、灼烧、 、称量。
 (5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
 ①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、量筒、药匙、胶头滴管外,还需
。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、量筒、药匙、胶头滴管外,还需
。
 ②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是
。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是
。
 a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
 (6)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天需服用含服_________mg含FeSO4·7H2O的片剂。
(6)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天需服用含服_________mg含FeSO4·7H2O的片剂。
19. (10分)某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
(10分)某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
 甲同学认为沉淀可能是CuCO3;
甲同学认为沉淀可能是CuCO3;
 乙同学认为沉淀可能是Cu(OH)2;
乙同学认为沉淀可能是Cu(OH)2;
 丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
 Ⅰ.(1)乙同学的观点,你认为其原理是(用离子方程式表示):
Ⅰ.(1)乙同学的观点,你认为其原理是(用离子方程式表示):
 。
。
 (2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是 。
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是 。
 Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。

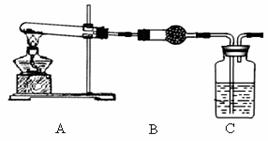
 (3)B装置中试剂的化学式是 , C装置中试剂的名称是
。
(3)B装置中试剂的化学式是 , C装置中试剂的名称是
。
 (4)能证明乙同学观点正确的实验现象是
。
(4)能证明乙同学观点正确的实验现象是
。
 (5) 若丙同学的观点正确,用上述装置通过B、C中质量的增加来定量测定沉淀的组成,该装置主要存在的缺点是
。
(5) 若丙同学的观点正确,用上述装置通过B、C中质量的增加来定量测定沉淀的组成,该装置主要存在的缺点是
。
18. 常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
 A.该溶液中c(H+)=1×10-3 mol·L-1
A.该溶液中c(H+)=1×10-3 mol·L-1
 B.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中
B.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中
 2c(H+)+c(HA)=c(A-)+2c(OH-)
2c(H+)+c(HA)=c(A-)+2c(OH-)
 C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
 c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
 D.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中
D.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中
 c(Na+)>c(A-)>c(OH-)>c(H+)
c(Na+)>c(A-)>c(OH-)>c(H+)




17. 已知如下物质的溶度积常数:FeS:Ksp=6.3×l0-18mol2·L-2;CuS:Ksp=1.3×10-36mol2·L-2;ZnS:Ksp=1.6×10-24mol2·L-2。下列说法正确的是
已知如下物质的溶度积常数:FeS:Ksp=6.3×l0-18mol2·L-2;CuS:Ksp=1.3×10-36mol2·L-2;ZnS:Ksp=1.6×10-24mol2·L-2。下列说法正确的是
 A.同温度下,CuS的溶解度小于ZnS的溶解度
A.同温度下,CuS的溶解度小于ZnS的溶解度
 B.将足量CuSO4溶解在0.1mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3 ×10-35mol·L-1
B.将足量CuSO4溶解在0.1mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3 ×10-35mol·L-1
 C.因为H2SO4是强酸,所以Cu2++H2S=CuS↓+2H+不能发生
C.因为H2SO4是强酸,所以Cu2++H2S=CuS↓+2H+不能发生
 D.除去某溶液中的Cu2+,可以选用FeS做沉淀剂
D.除去某溶液中的Cu2+,可以选用FeS做沉淀剂
16. 根据下列有关图象,说法正确的是
根据下列有关图象,说法正确的是


 A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
 B.由图Ⅱ知,反应在t6时,NH3体积分数最大
B.由图Ⅱ知,反应在t6时,NH3体积分数最大
 C.由图Ⅱ知,t3时采取降低反应温度的措施
C.由图Ⅱ知,t3时采取降低反应温度的措施
 D.Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
D.Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
15. 在t℃时,将a g NH3完全溶解于水,得到V mL饱和溶液,测得该溶液的密度为
在t℃时,将a g NH3完全溶解于水,得到V mL饱和溶液,测得该溶液的密度为

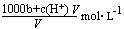 ρg·cm-3,质量分数为ω,其中n(NH4+)为b mol。下列叙述中,错误的是
ρg·cm-3,质量分数为ω,其中n(NH4+)为b mol。下列叙述中,错误的是
 A.溶液中c(OH-)=
A.溶液中c(OH-)=

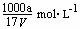 B.溶质的物质的量浓度c=
B.溶质的物质的量浓度c=

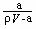 C.溶质的质量分数ω= ×100%
C.溶质的质量分数ω= ×100%
 D.上述溶液中再加入V mL水后,所得溶液质量分数大于0.5ω
D.上述溶液中再加入V mL水后,所得溶液质量分数大于0.5ω




14. 已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496
kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496
kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
 A.920 kJ B.557 kJ C.436
kJ
D.188 kJ
A.920 kJ B.557 kJ C.436
kJ
D.188 kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com