
题目列表(包括答案和解析)
11.在10℃时反应速率vB为0.3 mol·(L·s)-1,则vA‘为0.1 mol·(L·s)-1, 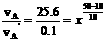 解得x=4。
解得x=4。
10.④>②=③>①
讲析:比较化学反应速率大小的方法:
①由反应速率之比与物质的化学计量数之比,比较后作出判断。②将不同物质表示的速率换算为同一物质表示的速率,再比较速率数值大小。
1.D 2.D 3.C 4.A 5.AB 6.BD 7.C 8.AC 9.CD
 讲析:1.化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。本题中未明确指出容器的容积,故无法判断。 3.压强对反应速率影响的原因仅仅是由于气体压强的改变而引起气体浓度的改变,从而导致速率的改变。C选项涉及的反应中反应物和生成物都没有气体,故选C。 4.答题时不能只考虑混合前两反应物的浓度,否则易误选B。确定反应速率大小的原因是两种反应物的溶液与一定量的水混合后所得溶液中反应物浓度的大小。前者混合溶液中两反应物浓度都为1/25mol·L-1,后者混合溶液中两反应物浓度都为1/30mol·L-1,故ν1>ν2。 5.增加固体接触面积和增大气体压强,可加快正反应速率。C中Fe2O3不是该反应的催化剂,D项中降温可减小速率。故选AB。 6.由图示可知, EF段表示的平均速率最快;EF段,用盐酸表示该反应的平均反应速率为2n(CO2)/(0.1L×1min)= 2×0.02mol/(0.1L×1min)=0.4mol/(L·min);OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:4:1;G点表示收集的CO2的量最多,为784mL。 7.块状CaCO3不如粉状CaCO3反应快,由各自的量决定了最后生成CO2一样多,且反应就此停止。 8.根据同温同体积密闭容器中,压强之比等于物质的量的之比列式求解。准确地解决此类问题,一般需要建模,这样各物质之间量的关系非常明确。 9.催化剂能同等倍数地改变正、逆反应速率,A正确。加压v正、v逆均增大,气体体积之和大的一侧增大倍数大于体积之和小的一侧增加的倍数,B正确。降温v正、v逆均减小,吸热反应减小的倍数大于放热反应减小的倍数,C不正确。加入氩气,如恒温恒容,v正、v逆均不变;如恒温恒压,相当于降压,D不正确。
讲析:1.化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。本题中未明确指出容器的容积,故无法判断。 3.压强对反应速率影响的原因仅仅是由于气体压强的改变而引起气体浓度的改变,从而导致速率的改变。C选项涉及的反应中反应物和生成物都没有气体,故选C。 4.答题时不能只考虑混合前两反应物的浓度,否则易误选B。确定反应速率大小的原因是两种反应物的溶液与一定量的水混合后所得溶液中反应物浓度的大小。前者混合溶液中两反应物浓度都为1/25mol·L-1,后者混合溶液中两反应物浓度都为1/30mol·L-1,故ν1>ν2。 5.增加固体接触面积和增大气体压强,可加快正反应速率。C中Fe2O3不是该反应的催化剂,D项中降温可减小速率。故选AB。 6.由图示可知, EF段表示的平均速率最快;EF段,用盐酸表示该反应的平均反应速率为2n(CO2)/(0.1L×1min)= 2×0.02mol/(0.1L×1min)=0.4mol/(L·min);OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:4:1;G点表示收集的CO2的量最多,为784mL。 7.块状CaCO3不如粉状CaCO3反应快,由各自的量决定了最后生成CO2一样多,且反应就此停止。 8.根据同温同体积密闭容器中,压强之比等于物质的量的之比列式求解。准确地解决此类问题,一般需要建模,这样各物质之间量的关系非常明确。 9.催化剂能同等倍数地改变正、逆反应速率,A正确。加压v正、v逆均增大,气体体积之和大的一侧增大倍数大于体积之和小的一侧增加的倍数,B正确。降温v正、v逆均减小,吸热反应减小的倍数大于放热反应减小的倍数,C不正确。加入氩气,如恒温恒容,v正、v逆均不变;如恒温恒压,相当于降压,D不正确。
5.(1)KIO3;0.5
(2)决定反应速率的一步反应是慢反应①
(3)I2会使淀粉变蓝,从反应过程和机理看,只有当SO32-消耗完,才会有I2存在。
检测提高
1.B 2.C 3.BC 4.AC
讲析:1.由题知2s时C的浓度为0.6mol/L,根据化学方程式中化学计量数比,可算出B的变化浓度为0.3 mol/L,进而确定B的浓度是(1 mol/L-0.3 mol/L)=0.7 mol/L;A的变化浓度为0.6 mol/L,从而求A的转化率为30%;用C表示的反应的平均速率为0.3mol·(L·min)-1,可推知用A表示的反应的平均速率为0.3 mol·(L·min)-1,用B表示的反应的平均速率为0.15 mol·(L·min)-1。对照各选项,符合题意的是B。 2.开始时盐酸浓度和镁带表面积会影响反应速率,又因此反应为放热反应且有H2产生,则温度和容器的密闭情况也成为影响该反应速率的因素。 3.加入碳酸钠固体,反应掉硫酸,会使生成氢气总量减少,A不选;加入水,溶液中c(H+)减低,反应速率减缓,但溶液中H+的物质的量不变,故生成氢气总量不变,B可选;加入硫酸钾溶液,相当于加水稀释,C可选。加入硫酸铵固体,显然不能减慢反应速率,D不选。故答案为B、C。 4.C为固态反应物,增加其用量对反应速率几乎没有影响;容器体积缩小一半相当于压强增大一倍,浓度增大,正、逆反应速率均增大;体积不变,充入N2体系总压强增大,但反应混合物浓度并未改变,反应速率基本不变;充入N2使容器体积增大,总压强不变,但反应混合物浓度同等程度变小,正、逆反应速率均变慢。
10.(1)3X+Y  2Z
2Z
(2)0.05 mol·(L·min)-1;0.04 mol·(L·min)-1
(3)5min时,反应达到了平衡,各物质的反应速率不再改变,故5min后Z的生成速率与5min末Z的生成速率相等。
第11课时 (B卷)
纠错训练
9. (1)2KCl O3+6NaHSO3==3Na2SO4+2KCl+3H2SO4,溶液中c(H+)增大,化学反应速率加快。
(1)2KCl O3+6NaHSO3==3Na2SO4+2KCl+3H2SO4,溶液中c(H+)增大,化学反应速率加快。
(2)随着反应的进行,H2SO4和NaHSO3之间反应使H+及HSO3-浓度减小,后期化学反应速率减慢。
8.(1)0.25 mol·(L·min)-1 (2)0.25 mol·(L·min)-1
(3)因在同一反应里,v(HCl)=2 v(FeCl2),对比前2min和后4min的反应速率知前2min时HCl的浓度较大,所以前2min反应速率较快(实际上随着反应的进行,反应物浓度不断减小,反应速率肯定要减慢。)
7.升高温度和使用催化剂。升高温度,反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子;使用催化剂能够降低反应所需要的能量,从而使更多的反应物分子成为活化分子;因此,升高温度和使用催化剂都可以增大反应物分子中活化分子的百分数。
2.0m=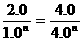 则n=1/2
则n=1/2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com