
题目列表(包括答案和解析)
2.(2002年上海高考题)在下列有关晶体的叙述中错误的是 ( )
A. 离子晶体中,一定存在离子键
B. 原子晶体中,只存在共价键
C. 金属晶体的熔沸点均很高
D. 稀有气体的原子能形成分子晶体
(本题考查晶体的结构和性质,答题时要注意晶体结构特征和思维的辨证性)
1.(2002年上海高考题)下列分子的电子式书写正确的是 ( )
A 氨
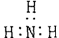 B
四氯化碳
B
四氯化碳 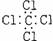
C 氮  D 二氧化碳
D 二氧化碳

(本题考查电子式的书写,答题时注意物质类型和书写形式)
6. 了解几种典型物质如氯化钠、氯化铯、金刚石、二氧化硅、干冰以及石墨等晶体的空间结构特征,培养对原子、分子、化学键等微观结构的一定的三维空间想象能力。
典型题点击
5. 晶体性质(硬度大小、熔沸点高低等物理性质)的比较依据
⑴异类晶体:一般来说,晶体的熔沸点:原子晶体>离子晶体>分子晶体,而金属晶体却差别很大。
⑵同类晶体:①原子晶体的熔沸点取决于共价键的强弱(一般比较原子半径的大小);②离子晶体的熔沸点取决于离子键的强弱(离子半径越小,离子电荷数越多,离子键越强)③分子晶体的熔沸点取决于分子间作用力的大小(含氢键)。
4. 晶体类型的分类及判断方法
可据元素组成来判断:金属单质为金属晶体;金刚石、晶体硅、二氧化硅、碳化硅等为原子晶体;含金属阳离子或铵根离子的化合物为离子晶体;其他由非金属元素组成的单质和化合物为分子晶体。
3. 电子式的书写方法
⑴要区别“用电子式表示物质的形成过程”和“用电子式表示物质”的提法不同,表示也应不同。
 ⑵注意离子化合物与共价化合物表示上的区别,如是否用[]及“+”“-”等。
⑵注意离子化合物与共价化合物表示上的区别,如是否用[]及“+”“-”等。
⑶注意一些较复杂化合物电子式的正确书写。如Na2O2、H2O、HClO、Al2O3、Mg3N2、(NH4)2S、Ba(OH)2等。
2. 分子极性的判断:⑴单质分子一般为非极性分子;⑵化合物①AB型分子全为极性分子, ② ABn型分子:若A的化合价等于其价电子数目,则分子的空间结构对称,其分子为非极性分子;若A的化合价不等于其价电子数目,则分子的空间结构不对称,其分子为极性分子。
1. 化学键包括离子键、共价键和金属键,应从原子结构的特征出发分析单质和化合物的粒子(分子、离子、原子)间的强烈相互作用所形成的化学键,切实掌握化学键的概念、分类、实质与特征,了解键的极性;并注意与分子间作用力和氢键的区别。
13.(1)因体积恒定的容器中,温度与压强均未改变,则反应前后气体体积不变,x+2=2+3,x=3
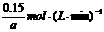
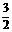 v(A)=
v(A)=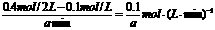
则v(B)= v(A)=
(2)若温度不变,压强变为9/10P,由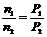
参加反应的n(A)=0.4mol-0.1mol·L-1×2L=0.2mol,
平衡时n(A)=0.4mol-0.2mol=0.2mol
参加反应的n(B)=0.3mol,平衡时n(B)=0.6mol-0.3mol=0.3mol
生成n(C)=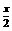 ×0.2mol=0.1x mol,n(D)= 0.2mol
×0.2mol=0.1x mol,n(D)= 0.2mol
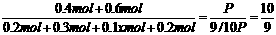
x=2,v(C)=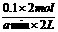 =
=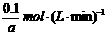
14(1) 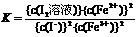 ;向右
;向右
(2) (C) 大于.
15(1)v0=2.73×10-8 mol/(L•s)
(2)当I2消耗一半时,
c(CH3COCH3)=0.1mol/L-1/2×0.01mol/L=0.095mol/L,
c(H+)=0.1mol/L+1/2×0.01mol/L=0.015mol/L,此时的反应速率vt=2.73×10-5×0.095×0.015mol/(L•s)=3.89×10-8 mol/(L•s)显然 vt > v0,所以反应速率比开始时快。
12.A的物质的量浓度 0.75 mol/L
1mol/L <C(B)<1.5 mol/L
讲析:从反应关系看,B物质的量浓度变化值为A的2倍。由图示可知,A物质的量浓度变化值大于0.5mol/L,小于0.75 mol/L,则1mol/L <C(B)<1.5 mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com