
题目列表(包括答案和解析)
2.下列叙述正确的是
A.汽油、柴油和植物油都是碳氢化合物
B.乙醇可以被氧化为乙酸,二者都能发生酯化反应
C.甲烷、乙烯和苯在工业上都可通过石油分馏得到
D.含5个碳原子的有机物,每个分子中最多可形成4个C-C单键
3 .化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下
.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下
列实验中所选用的仪器合理的是 ①用50m1量筒取5.2mL稀硫酸; ②用分液漏斗分离苯
和四氯化碳的混合物;③用托盘天平称量11.7g氯化钠晶体;④用碱式滴定管取23.10mL
溴水; ⑤用瓷坩埚灼烧各种钠的化合物;⑥用250mL容量瓶配制250mL 0.2mol/L的NaOH
溶液。
 A.①②④ B.②③④⑥ C.③⑥ D.③⑤⑥
A.①②④ B.②③④⑥ C.③⑥ D.③⑤⑥
1.背景材料:①“神舟七号”的防护层由聚四氟乙烯和玻璃纤维布组合而成;②据不完全统计。目前我国年产垃圾总量约5亿吨,其中三分之二的垃圾是可以回收再利用的;③汞是有毒的金属;④据环境质量监测所抽查显示,新装修住房甲醛含量七成超标。⑤在广东、香港海域.渤海湾均出现过大面积的赤潮。⑤绿色化学(Green Chemistry)又称环境无害化学(Environmental Benign Chemistry)或清洁化学,是从源头上防止污染产生或把化学过程对环境的负面影响降低到最低程度的化学。
据此判断,下列说法正确的是
(1)“神舟七号”的防护层是复合材料,四氟乙烯属于不饱和烃。
(2)将垃圾分类并回收再利用,既节约自然资源,又防止污染,符合可持续发展的要求,正成为垃圾处理的发展方向。
(3)无机汞(如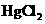 )会在水中微生物的作用下转化为毒性更大的有机汞(如
)会在水中微生物的作用下转化为毒性更大的有机汞(如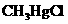 )。
)。
(4)为降低甲醛含量,新装修住房应紧闭门窗,并放置一盆水。
(5)赤潮是指在一定条件下海洋中某些生物短时间内大量繁殖或聚集,使海水变红色、褐色的现象。
(6)绿色化学就是生产绿色化学物质的工艺。
A.(1)(3)(6) B.(1)(4)(5) C.(2)(3)(5) D.(2)(4)(6)
6.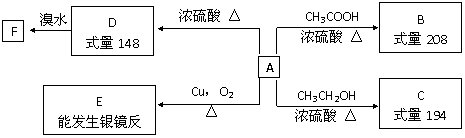 某芳香族化合物A,苯环上只有一个取代基,完全燃烧只生成二氧化碳和水,一定条件下存在如下图所示的转化关系:
某芳香族化合物A,苯环上只有一个取代基,完全燃烧只生成二氧化碳和水,一定条件下存在如下图所示的转化关系:
请回答下列问题:
⑴A的摩尔质量为______,在一定条件下B可能发生的化学反应的类型有_______(填序号)。
①水解反应。②取代反应。③加成反应。④消去反应。⑤加聚反应。
⑵C的结构简式为_______________,E的结构简式为_________________。
⑶写出下列转化的化学方程式:
①A→B:______________________________________________________________。
②D→F:______________________________________________________________。
⑷符合下列三个条件的A的同分异构体的数目有__________个
①含有二取代苯环结构。②与A有相同的官能团。③能与FeCl3溶液发生显色反应。
5.盐酸、硫酸和硝酸是中学阶段常见的三种酸。请就三种酸与金属铜反应的情况, 回答下列问题:(1)稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解,该反应的离子方程式为 。
某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸。请在方格中画出该装 置
置
(2)由4根同质量的电极材料(Ag Cu Pt)组成下列装置。下列装置A为 池(填写”原电”或”电解”),发生氧化反应的电极反应式为: ,B池中阳极的电极反应式为:______________________________。当关闭电键k一段时间,发现Ag棒与 Cu棒质量差为28g时,则装置B产生气体的总质量为 g(电解质溶液足量)。
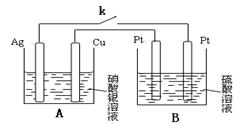
(3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗 ? (填 “同意”或“不同意”),理由是
4.A-G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且A为黑色的固体,B为红棕色, C是人类最早提炼并广泛使用的金属。它们之间有如下转化关系(其中反应③④⑦的产物中还有水)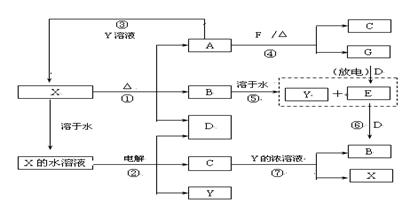
请回答下列问题:
(1)写出G分子的电子式: ;
(2)写出反应⑦的离子方程式是: ;
(3)写出电解X溶液的阳极反应式: ;
(4)写出反应④的化学方程式: ;
(5)若使F按下列途径完全转化为Y:
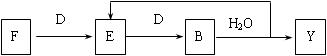 则参加反应的F与整个过程中消耗D的物质的量之比为 。
则参加反应的F与整个过程中消耗D的物质的量之比为 。
3.右图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置。请回答下列问题:

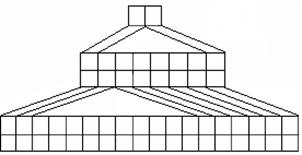
(1)请在上图中将铁元素所在族的位置全部涂黑。
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”。请写出NaH的电子式 。
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时 (“抑制”、“促进” 或“不影响”)水电离,其反应的离子方程式为 ;土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带 (“正”或“负”)电荷。
(4)下列叙述正确的是 。
A.h的最高价氧化物对应的水化物是一种强碱
B.硒化氢的稳定性强于f的氢化物的稳定性
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和能使带火星的木条复燃的气体,若沉淀和气体的物质的量之比为2:1,反应的离子方程式为
2.根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见的反应,其中B、G、I、J、L均为常见单质,且B、D、J、L均为气体。A是硫酸工业生产中的重要矿石原料的主要成分,其相对分子质量为120。
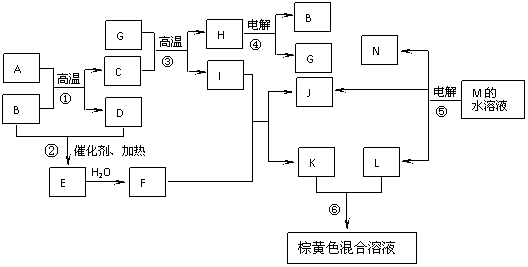
(1)写出反应①的化学方程式 ;
完成反应⑥的离子方程式 。
(2)写出反应⑤阴极的电极反应 ;
若用B、J、N和铂电极构成原电池,其负极的电极反应为: 。
(3)M的晶体模型如下图所示,设晶体中阴、阳离子间的最短距离为d cm,M的摩尔质量为a g/mol,NA为阿伏加德罗常数,则晶体M的密度可表示为 g/cm3。

1.A、B、C、D四种短周期元素的原子序数依次增大,A元素的气态氢化物与A元素的最高价氧化物对应的水化物能反应生成盐;B、C、D同周期,它们的最高价氧化物对应的水化物两两之间都能反应生成盐和水,B和D可组成化合物BD,回答下列问题。
(1)B的最高价氧化物对应的水化物与C的氧化物在溶液中反应的离子方程式为:
。
(2)B、D的最高价氧化物对应的水化物在稀溶液中反应,若生成0.25mol水时放出Q kJ的热量,则该反应的热化学方程式为 。
(3)在BHCO3的水溶液中,c(B+)-c(H2CO3)= 。
(4)在一定条件下,将2molA2和3molH2在一固定体积的密闭容器中反应达到平衡状态,此时容器中混合气体的平均相对分子质量为15.5,则H2的转化率为 。若平衡后,再按n(A2):n(H2):n(AH3)=3:3:2向该密闭容器中充入气体,当重新达到平衡后,A2
在平衡混合气中的百分含量较原平衡 (填“大”、“小”或“不变”)。
26、(10)
光催化制氢是化学研究的热点之一。科学家利用含有呲啶环(呲啶的结构式为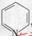












其性质类似于苯) 的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
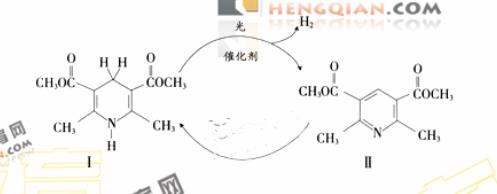
(1)化合物II的分子式为______________。
(2)化合物I合成方法如下(反应条件略,除化合物III的结构未标明外,反应式已配平);
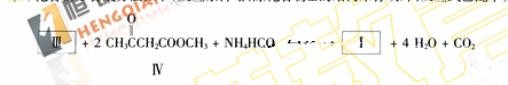
化合物III的名称是________________。
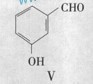
(3)用化合物V(结构式见右图)代替III作原料,也能进行类似的上述反应,所得有机关物的结构式为___________________。
(4)下列说法正确的是_____________(填字母)
A、化合物V的名称是间羟基苯甲醛,或2-羟基苯甲醛
B、化合物I具有还原性;II具有氧化性,但能被酸性高锰酸钾溶液氧化
C、化合物I、II、IV都可发生水解反应
D、化合物V遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应
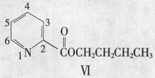
(5)呲啶甲酸酯可作为金属离子的萃取剂。2-呲啶甲酸正丁酯(VI)的结构式见右图,其合成原料2-呲啶甲酸的结构式为_________________;VI的同分异构体中,呲啶环上只有一氢原子被取代的呲啶甲酸酯类同分异构体有_________________种。
27:(10分)
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。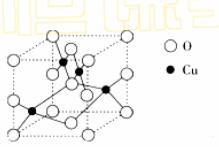
(1) Cu位于元素周期表第I B族。Cu2+的核外电子排布式为__________。
(2) 右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为_________。
(3) 胆矾CuSO4·5H2O可写成[Cu(H2O)]SO4 H2O,其结构示意图如下:
下列说法正确的是__________(填字母)。
A
在上述结构示意图中,所有氧原子都采用 杂化
杂化
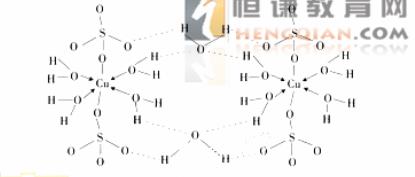
B 在上述结构示意图中,存在配位键、共价键和离子键
C 胆矾是分子晶体,分子间存在氢键
D 胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH2)2]2+配离子。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是_______________。
(5)Cu2O的熔点比Cu2S的_________(填“高”或“低”),请解释原因__________。
本资料由《七彩教育网》 提供!
25.(9分)
叠氮化合物应用广泛,如NaN3,可用于汽车安全气毂pHCH2N3可用于合成化合物V(见下图,仅列出部分反应条件PH-代表苯基 )
)
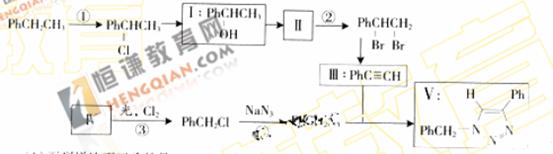
(1) 下列说法不正确的是-------------(填字母)
A反应①④属于取代反应
B化合物I可生成酯,但不能发生氧化反应
C一定条件下化合物Ⅱ能生成化合物I
D一定条件下化合物Ⅱ能与氢气反应类型与反应②相同
(2) 化合物Ⅱ发生聚合反应的化学方程式为---------------------(不要求写出反应条件)
(3) 反应③的化学方程式为-----------------(要求写出反应条件)
(4) 化合物Ⅲ与pHCH2N3发生环加成反应成化合物V,不同条件下环加反应还可生成化合物V的同分异构体。该同分异物的分子式为---------------------------结构式为---------------------
(5) 科学家曾预言可合成c(N3)4。其可分解成单质,用作炸药。有人通过NaN3与NC-CCl3,反应成功全成了该物质下列说法正确的是------------------------(填字母)
A该合成反应可能是取代反应
Bc(N3)4与甲烷具有类似的空间结构
C c(N3)4不可能与化合物Ⅲ发生环加反应
D c(N3)4分解爆炸的化学反应方程式可能为c(N3)4 C+6N2
C+6N2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com