
题目列表(包括答案和解析)
23. (12分)工业上用铝土矿(含氧化铝、氧化铁)制取金属铝的生产过程如下框图
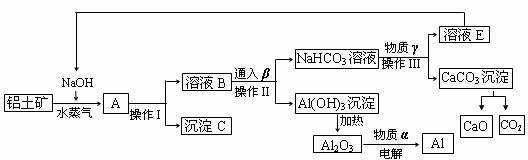
请回答下列问题:
(1)写出铝土矿与氢氧化钠溶液反应的离子方程式 。
(2)沉淀C的化学式为______,该物质除了用于金属冶炼以外,还可用作 。电解熔融的氧化铝时,物质α是______,其作用是 。
(3)在实验室中欲从溶液E中得到较纯净的固体NaOH,需要进行的操作顺序是:_______、趁热过滤、__________、 。
(4)生产过程中,可以循环使用的物质有四种,除NaOH、H2O以外,另外两种物质是
______、 (填化学式)。
(5)若工厂每月生产中参加反应的NaOH为20吨, 生产过程中损失的NaOH为0.1 吨,则该工厂每月要购买的NaOH为_________吨。
22.(12分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀。
试回答下列问题:
(1) 写出化学式:A___________ B___________ D_________
(2) E溶液呈酸性的原因是:(用离子方程式表示)_______________________________
(3 ) 将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(4 )在100mL0.1mol·L-1 E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 mol
21.(9分)石灰石的主要成份是碳酸钙,含氧化钙约40~50%,较好的石灰石含CaO约45~53%。此外还有SiO2、Fe2O3、Al2O3及MgO等杂质。测定石灰石中钙的含量时将样品溶于盐酸,加入草酸铵溶液,在中性或碱性介质中生成难溶的草酸钙沉淀 (CaC2O4·H2O),将所得沉淀过滤、洗净,用硫酸溶解,用标准高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,间接求出钙的含量。涉及的化学反应为: H2C2O4 + MnO4- + H+ → Mn2+ + CO2 ↑+ H2O(未配平)。CaC2O4 沉淀颗粒细小,易沾污,难于过滤。为了得到纯净而粗大的结晶,通常在含Ca2+的酸性溶液中加入饱和 (NH4)2C2O4 ,由于C2O42-浓度很低,而不能生成沉淀,此时向溶液中滴加氨水,溶液中C2O42-浓度慢慢增大,可以获得颗粒比较粗大的CaC2O4沉淀。沉淀完毕后,pH应在3.5~4.5,这样可避免其他难溶钙盐析出,又不使CaC2O4溶解度太大。根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的沉淀物主要是
(2)沉淀 CaC2O4要加入沉淀剂饱和的 (NH4)2C2O4 溶液,为什么?
(3)工业中通常先用0.1%草酸铵溶液洗涤沉淀,再用冷的蒸馏水洗涤,其目的是:
(4)若开始用去m g样品,最后滴定用去浓度为c mol/L 的KMnO4 溶液V mL,推出
CaO含量与 KMnO4的定量计算关系。ω%=
20.(10分)已知Fe2O3与H2反应会因温度不同而可能生成Fe3O4。兴趣小组在用H2还原Fe2O3
的实验中,用磁铁吸出生成的黑色粉末X。为探究X的组成,他们进行了如下实验。
(1)甲同学认为黑色粉末能被磁铁吸附,因此X是铁。但乙同学不同意他的结论,原因是
。
(2)乙同学:先将少量黑色粉末X放入装有足量硫酸铜溶液烧杯中,振荡,固体部分溶解,有极少量红色物质析出,过滤;然后向滤渣加入盐酸,滴加几滴KSCN溶液,溶液出现血红色。通过现象分析,丙同学得出X的组成是Fe和Fe3O4.
①滴加KSCN溶液的目的是:________________________________________
②若在粉末X直接加入盐酸、KSCN溶液,溶液不出现血红色。不出现血红色的原因是(用离子方程式表示)_________________________________________________________。
(3)丁同学的实验方案:
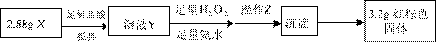
①操作Z是 。
②通过以上数据,得出2.88g黑色粉末X中各成分的物质的量为 ___________________ 。
19.(13分)甲酸(CH2O2),俗称蚁酸,结构式为:
某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了
相关实验加以验证:
猜想I:甲酸具有酸性;
实验I:在甲酸溶液中滴加紫色石蕊试液;
 猜想II:甲酸能发生银镜反应;
猜想II:甲酸能发生银镜反应;
实验II:(步骤如图12所示);
回答下列问题:
⑴ 请你再设计出至少2个实验
方案来验证甲酸的酸性: 、
;
⑵ 请你进一步设计实验方案证明甲酸是弱酸: ;
⑶ 依图12所示的实验,加热20分钟后并没有出现预期的实验现象。该小组同学预期的实验现象是 ,请你从理论上简单解释实验中没有出现该现象的原因 ;
⑷ 在仔细分析甲酸分子组成元素的基础上,请你再提出一个甲酸在浓硫酸作用下可能具有的性质的猜想并设计一个实验方案验证你的猜想:
① 你提出的猜想是 ;
② 你设计的实验方案是:
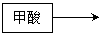
 实验方案请参考如下形式:
实验方案请参考如下形式:
18.现有用离子交换膜和石墨作电极的电解槽电解饱和的Na2SO4
 溶液生产NaOH和H2SO4 ,下列说法中正确的是
溶液生产NaOH和H2SO4 ,下列说法中正确的是
A.气体A是H2 ,溶液E是稀硫酸
B.气体B是H2 ,溶液D是NaOH溶液
C.Na2SO4 溶液由G口加入,F口通入稀硫酸
D.要定期补充水,不用补充Na2SO4
17.用过量稀H2SO4与56.6g FeS和Fe(OH)3的混合物反应,可得到3.2g硫,原混合物中FeS的质量可能是
A.8.8g B.21.4g C.35.2g D.47.8g
16.为了研究在温度对苯催化加氢的影响,以检验新型镍催化剂的性能。其他条件相同,定时取
样分析成分:
|
温度/℃ |
85 |
90 |
95 |
100 |
110-240 |
280 |
300 |
320 |
340 |
|
苯 |
96.05 |
91.30 |
91.55 |
80.85 |
0 |
23.35 |
36.90 |
55.99 |
72.37 |
|
环己烷 |
3.95 |
8.7 |
8.45 |
19.15 |
100 |
76.65 |
63.10 |
44.01 |
27.63 |
(采用微型反应装置,压强为0.78MPa,氢苯摩尔比为6. 5∶1)
下列说法错误的是
A.随着反应温度的升高,苯的转化率先升高后降低
B.在110~240℃苯的转化率为100%。说明该镍催化剂活性较高,能够在较宽的温度范围内催化
而且不发生副反应
C.压强与氢苯摩尔比的增大都有利于提高苯的转化率
D.当温度超过280℃,苯的转化率迅速下降,可能是因为该反应为吸热的可逆反应
15. 下列离子方程式或化学方程式中正确的是
A.向Fe(OH)3中加入大量的氢溴酸:Fe(OH)3+3H+ = Fe3++3H2O
B.为了提取镁,在海水中加入熟石灰:MgSO4 + 2OH―== SO42― + Mg(OH)2
C.当钢铁处于酸性很弱或中性环境中发生吸氧腐蚀,正极反应:4H+ + O2 + 4e― == 2H2O
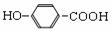 D. 尼泊金酸(
)与碳酸氢钠溶液反应:
D. 尼泊金酸(
)与碳酸氢钠溶液反应:

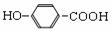 +2HCO3- →
+ CO2↑+2H2O
+2HCO3- →
+ CO2↑+2H2O
14. 对下列各溶液的叙述正确的是
A.将①0.01mol/L的CH3COOH溶液、②0.01mol/L的盐酸、③pH=12的氨水、④pH=12 的NaOH溶液稀释相同倍数后溶液的pH:③>④>①>②
B.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:2c (Na+) = c (S2―) +c (HS―)+ c (H2S)
C.等物质的量浓度的硫酸与醋酸钠溶液等体积混合,2c(SO42-) = c(H+) + c(CH3COOH)
D.向氨水中加水稀释,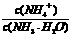 增大
增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com