
题目列表(包括答案和解析)
11.生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池,其工作原理如图所示。已知C1极的电极反应式为: C2H5OH+3H2O-12e-===2CO2+12H+。下列有关说法不正确的是
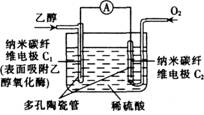 A.C1极为电池负极,C2极为电池正极
A.C1极为电池负极,C2极为电池正极
B.C2极的电极反应式为O2+4H+ +4e-===2H2O
C.该生物燃料电池的总反应为:C2H5OH+3O2===2CO2+3H2O
D.电子由C2极经外电路导线流向C1极
10.将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达平衡:X(g)+Y(g) 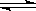 2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述不正确的是
2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述不正确的是
A.升高温度,X的体积分数增大
B.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
C.增大压强(缩小容器体积),Z的浓度不变
D.保持容器体积不变,充入一定量的Z,X的转化率减小
9.有M、R两种主族元素,已知M2-离子与R+离子核外电子数之和为20,则下列说法不正确的是
A.M与R的质子数之和一定等于19
B.M、R可能分别处于第二周期和第三周期
C.M、R可能分别处于第三周期和第二周期
D.M与R的质子数之差可能等于7
8.在下列溶液中,一定能够大量共存的离子组是
A.pH为1的溶液:Ca2+、Na+、Mg2+、NO3-
B.滴加石蕊试液显红色的溶液:Fe3+、NH4+、C1-、SCN-
C.常温下,由水电离出的c(H+)=l0-14mo1·L-1的溶液中:CO32-、SO42-、Na+、K+
D.与铝反应放出氢气的溶液:Fe2+、SO42-、NO3-、Na+
7.若NA代表阿伏加德罗常数,下列说法正确的是
A.2.24LCO2中含有的原子数为0.3NA
B.标准状况下,2.24L Cl2与足量的Mg充分反应,转移的电子数目为0.2NA
C.18g重水(2H2O)含有10NA个电子
D.1 L 0.5mol·L-1 Na2CO3溶液中含有的CO32-数目为0.5NA
6.下列叙述正确的是
A. 汽油、柴油和植物油都是碳氢化合物
B.乙醇可以被氧化为乙酸,二者都能发生酯化反应
C.甲烷、乙烯和苯在工业上都可通过石油分馏得到
D.棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O
27. (16分)
(1)溶液变蓝色,烧瓶内气体由无色继而变成红色,气球胀大 (3分) (2)①CD (2分) ② 石棉网 (2分)
③4NO2+O2+2H2O=4HNO3或4NO+3O2+2H2O=4HNO3 (2分)
有一部分被吸入烧瓶 (2分)
④38.4 (3分) ⑤2Cu+4HNO3+O2=2Cu(NO3)2+2H2O (2分)
28(15 分)(1)羧基(2分)、碳碳双键(2分)
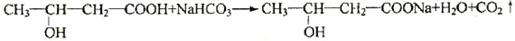 (2分)
(2分)
a(1分)、b(1分)
 (2)
(2分)
(2)
(2分)
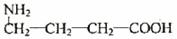
(3) (2分)
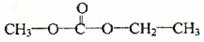
(4) (3分)
29(14分)每空各2分
(1)①提高原料的利用率,减少污染物的排放
②3.2~4.7 加水会将溶液稀释,不利于将滤液蒸发浓缩
③由于Cu2+发生水解:Cu2++2H2O Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
(2)Cu2++2e-=Cu
(3)N2O4 NO++NO
NO++NO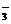 Cu+2N2O4=Cu(NO3)2+2NO↑
Cu+2N2O4=Cu(NO3)2+2NO↑
27、(16分)如下图的装置中:
 a是盛有标况下的空气(氧气占五分之一
a是盛有标况下的空气(氧气占五分之一
)和10mL 1.2mol/L硝酸的250mL 烧瓶。
b是未充气(实验开始前内部没有气体)
放有0.384g铜粉的气球。c是夹紧了的
弹簧夹。d中盛有足量的过氧化钠。
e是充有二氧化碳的针筒。整套装置已经过气密性检查合格。
(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是 。
(2)欲提高铜与硝酸反应的速度可采用多种不同的措施
①若用加入化学试剂法,下列试剂中可以使用的是(填代号) ;
A 蒸馏水 B 无水醋酸钠 C 石墨 D 硝酸银溶液(少量)
②也可用升高温度法,铁圈下方放酒精灯,铁圈上要放___________
③将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是
,
此时气球全在烧瓶外,还是有一部分被吸入烧瓶?____________________________.
④打开弹簧夹将二氧化碳扒推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉都溶解,至少需要推入二氧化碳 mL
⑤将上述全过程用一个总的化学方程式表示
_______________________________________________________________
28(15分)有机物A能使石蕊试液变红,在浓硫酸作用下可发生如下转化:
|
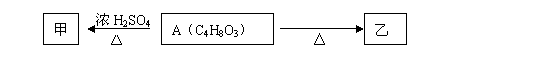

甲、乙分子式均为C4H6O2且都能使溴的四氯化碳溶液褪色。
(1) 甲分子所含官能团的名称是 。A溶液与碳酸氢钠反应的化学方程式为 。
乙能发生的化学反应有(填序号) a.酯化反应 b.氧化反应 c.水解反应
(2) B是A的同系物,相对分子质量小于A。B与浓硫酸作用得到的产物在一定条件下可发生加聚反应,该加聚反应的化学方程式为 。
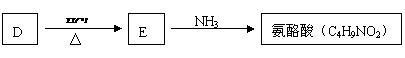 (3) A的一种同分异构体D(结构中无甲基)是化学法生产氨酪酸的原料。氨酪酸属于氨基酸,有降低人体血氨和促进脑代谢的作用。D、E及氨酪酸之间有如图所示的转化关系。(提示:
(3) A的一种同分异构体D(结构中无甲基)是化学法生产氨酪酸的原料。氨酪酸属于氨基酸,有降低人体血氨和促进脑代谢的作用。D、E及氨酪酸之间有如图所示的转化关系。(提示: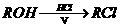 )
)
氨酪酸的结构简式为 。
(4) A的另一种同分异构体简称EMC,用于制造可充电电池。EMC在氢氧化钠溶液中水解可得到三种含碳化合物。EMC的结构简式为 。
29 (14分)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:


①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
不用加水的方法调节溶液pH的原因是 。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明) 。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
(3)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3 NH
NH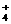 +NH
+NH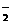 ,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是 ;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 。
,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是 ;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 。
6 b7 c 8 a 9 d 10 c 11 a 12 d 13 d
26 (15分)(其他合理答案参照本标准给分)
|
|
 (1)N≡N (2分)
(1)N≡N (2分)
(2) ∶Cl∶P∶Cl∶ P(s)+3/2Cl2(g)=PCl3(l);△H= –306 kJ/mol
|
|
|
|
(4)Cl2、NH3
13.根据相应的图像(图像编号与答案一一对应),判断下列相关说法正确的是( )
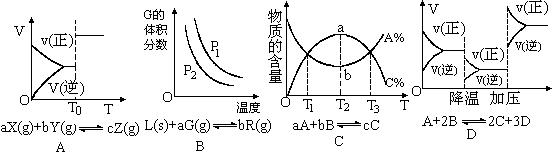
A.密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂
B.反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
C.物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应
D. 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体
26(15分)X、Y、Z为不同短周期非金属元素的气态单质。在一定条件下能发生如下反应:

 Y+X 甲(g),Y+Z 乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
Y+X 甲(g),Y+Z 乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
(1)X的结构式是 。
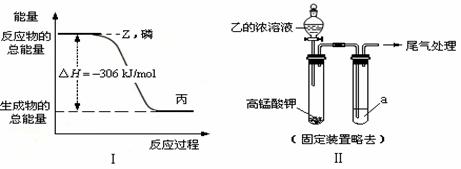

(2)磷在Z气体中燃烧可生成液态丙分子,也可生成固态丁分子。已知丙分子中各原子最外层均是8电子结构,丙的电子式是 ,磷单质和Z单质反应生成1 mol丙时,反应过程与能量变化如图Ⅰ所示,该反应的热化学方程式是 。
(3)某同学拟用图Ⅱ所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则a是 的水溶液。若仅将a换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是 。
(4)向一定浓度的BaCl2溶液中通入SO2气体,未见沉淀生成,若在通入SO2气体的同时加入由甲和乙中的一种或几种元素组成的某纯净物,即可生成白色沉淀,
该纯净物可能是________、________。
11.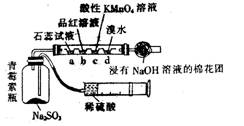 如图装置是用药穴板设计成的SO2气体多性质反应器,可制取SO2并探究其水溶性、漂白性、还原性等。下列有关叙述中不正确的是( )
如图装置是用药穴板设计成的SO2气体多性质反应器,可制取SO2并探究其水溶性、漂白性、还原性等。下列有关叙述中不正确的是( )
A.a处溶液由紫色变为无色
B.b处溶液由红色变为无色
C.c处反应的离子方程式为2MnO4- + 5SO2 + 2H2O == 2Mn2+ + 5SO42- + 4H+
D.d处反应原离子方程式为Br2 + SO2 + 2H2O === 2Br- + SO42- + 4H+
12我国发射的神舟号火箭有的是长征Ⅱ(F)型火箭,该火箭的燃
料是偏二甲基肼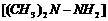 ,氧化剂是四氧化二氮,发生的反应可写成:
,氧化剂是四氧化二氮,发生的反应可写成:
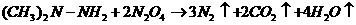

下列说法中,不正确的是( )
A. 在宇宙飞船舱中比地球上更难做过滤实验
B. 火箭点火后瞬间,从电视画面上看到有大量的红棕色气体,该气体是因为逸出的少量四氧化二氮气体生成了二氧化氮气体,即发生了反应: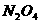
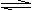
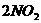

C. 相同条件下偏二甲基肼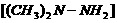 与
与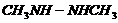 的沸点不同
的沸点不同 学科
学科
D. 每生成
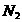 ,转移电子的物质的量为
,转移电子的物质的量为

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com