
题目列表(包括答案和解析)
9.NA代表阿伏加德罗常数,下列叙述正确的是
A.100 mL 1 mol·L-1的AlC13溶液中,含有A13+的数目为0.1 NA
B.5.6 gFe与足量的稀盐酸充分反应后,转移的电子数为0.3 NA
C.标准状况下, 22.4 LN2和O2的混合气体中,含原子数为NA
D. 2.8 g乙烯与一氧化碳的混合气体中,含分子数为0.1 NA
8.下列实验操作完全正确的是
|
编号 |
实验内容 |
实验操作 |
|
A |
探究钠与水的反应 |
用镊子从煤油中取出金属钠,切下一小块,小心放 入装满水的烧杯中 |
|
B |
配制5%的氯化钾溶液 100 g |
准确称取 5.0 g氯化钾固体,放入250 mL的烧杯中, 加 100 g蒸馏水,搅拌溶解 |
|
C |
检验NaHCO3样品中是否含有Na2CO3 |
取少量待检样品溶于水,滴加少量BaC12溶液,观 察是否有白色沉淀生成 |
|
D |
取出分液漏斗中的上层液体 |
下层液体从分液漏斗下端管口放出,关闭活塞,换 一个接收器,上层液体继续从下端管口放出 |
7.下列关于有机物的说法不正确的是
A.葡萄糖分子式:C6H12O6 B.石油的分馏和裂化均属于化学变化
C.乙酸和乙醇生成酯和水的反应属于取代反应 D.溴的四氯化碳溶液可用于鉴别乙烯和乙烷
6.2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是
A.NOx在铂表面发生氧化反应生成N2 B.CO在铂表面发生反应时起还原剂作用
C.铂在反应中起催化作用 D.NO、CO均能与人体中的血红蛋白结合
31.[化学--有机化学基础](13分)
A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
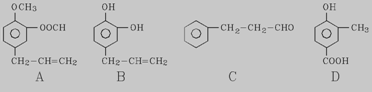
请回答下列问题:
(1)写出B中官能团的名称 。1mol B能与含 molBr2的溴水反应。
(2)既能使FeCl3溶液显紫色又能和NaHCO3反应放出气体的有 (用A、B、C、D填空)。
(3)按下图C经一步反应可生成E,E是B的同分异构体,则反应①属于 反应(填反应类型名称),写出反应②的化学方程式________________________________________________________。

(4)同时符合下列两项要求的D的同分异构体有4种
①化合物是1,2--二取代苯;
②苯环上的两个取代基分别为羟基和含有-COO-结构的基团
其中两种(G和H)结构简式如下图所示,请补充另外两种。
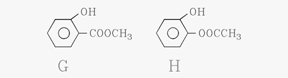
、 ,
(5)写出H与足量NaOH溶液共热反应的化学方程式 。
30.[化学--物质结构与性质](13分)
四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质、结构信息 |
价电子数为5的短周期元素;该元素形成的双原子分子一般情况下很稳定。 |
基态原子的M层有1对成对的p电子。 |
第三周期中第一电离能最小的元素。 |
原子最外电子层上s电子数等于p电子数。 单质为空间网状晶体,具有很高的熔、沸点。 |
(1)写出元素B基态原子的电子排布式 。
C离子的结构示意图 。
(2)元素A形成的气态氢化物的空间构型为 。
(3)A、D两种元素电负性的大小关系为:A D(填“>”、“<”或“=”)。
(4)元素B和C形成的化合物属于 (填“离子”、“原子”或“分子”)晶体。
(5)元素D形成的化合物D2H2属于 (填“极性”或“非极性”)分子。D2H2分子中 个π键,其中σ键的键能 (填“>”、“<”或“=”)π键的键能。
(6)元素B的氢化物熔点比水低,原因是___________________________________________________。
25.(15分)
某工业纯碱中含有少量NaCl和NaOH。学生课外活动小组为测定其中Na2CO3的质量分数,采样进行分析。通过集体讨论,选择下列适当装置连接,对设计方案不断完善,成功地完成了测定实验。
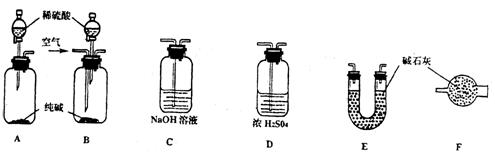
(1)下面是甲、乙、丙、丁、戊五位同学有关设计实验装置的讨论发言。请在空白处填写他们的发言内容:
甲:将装置A和E连接即可。因为Na2CO3与稀硫酸反应生成的CO2被E中的碱石灰吸收,通过分别测量反应前和反应后E的总质量,可求出Na2CO3的质量分数。
乙:还应在A和E之间连接装置__________(填序号),其目的是___________________________。
丙:应该用B装置取代A。从B装置的导管口处缓缓鼓入空气,其目的是___________________
_______________________________________________________________________________________。
丁:由于空气中含有_____________,若直接向B装置鼓入空气会导致实验测定结果__________(填“偏高”、“偏低”或“无影响”)。因此,应将鼓入的空气先通过装置 。
戊:E装置后还应连接装置F,其作用是__________________________________________________。
(2)学生课外活动小组测定的数据如下:
|
工业纯碱样品质量 |
反应前E的总质量 |
反应后E的总质量 |
|
5.5g |
43.9g |
46.1g |
计算该工业纯碱中Na2CO3的质量分数为___________________________。
(3)简述实验室测定上述样品中Na2CO3的质量分数的另一种方法(含实验仪器、实验步骤、实验现象)____________________________________________________________________________________
_______________________________________________________________________________________。
选考部分
第Ⅱ卷选考第30、31题为化学题,考生从两道化学题中各任选一题作答,若第30、31题都作答,则按第30题计分。
24.(15分)
Ⅰ.我国化学家侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
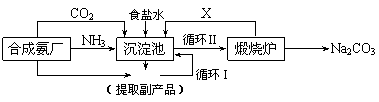

(1)使原料氯化钠的利用率从70%提高到90%以上,主要涉及了____________(填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是_________________(填写实验操作名称)。
(2)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加_______________________
(填写检验试剂的名称)。
(3)向母液(滤液)中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用有____(填序号)。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
 Ⅱ.某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:
Ⅱ.某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:
试填空。
(1)沉淀池中发生主要反应的化学方程式为________________________________________________,
该反应能够发生的原因是_________________________________________________________________。
(2)该生产过程中可以循环使用的物质X是_____________________(填化学式)。
(3)上述生产流程中,有关NH3的作用及说明正确的是_____________(填序号)。
A.提供制备所需的氮元素
B.增大CO32-的浓度促进反应发生
C.作反应的催化剂
D.生产1 mol (NH4)2SO4,至少消耗2 mol NH3
23.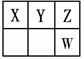 (15分)
(15分)
Ⅰ.短周期元素X、Y、Z、W在元素周期表中的位置如右图所示,其中X、Y、Z三种元素的质子数之和为21。
(1)氢元素与Z形成原子个数比为1∶1的化合物,其结构式为 。
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是 (用离子方程式表示) ;该溶液中各种离子浓度由大到小的顺序为 。
(3)写出Y的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式
,
反应中每转移8mol 电子,消耗的还原剂质量为 g。
Ⅱ.为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)===2CO2(g);ΔH=-566kJ·moL-1
2H2(g)+O2(g)===2H2O(g);ΔH=-483.6KJ·moL-1
H2O (g)===H2O(l);ΔH=-44.0KJ·moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式 。
Ⅲ.往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应:
CO+ H2O(g)=== CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。
Ⅳ.H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是 。
12.根据化学平衡知识,判断下列说法正确的是
A.在小苏打溶液中存在下列关系:c(HCO3-)=c(Na+)-c (CO32-)-c(H2CO3)
B.已知NaHA溶液呈弱碱性,则该溶液中下列各种微粒浓度大小排列顺序为:
c(Na+)>c(HA-)>c(A2-)>c(H2A)
C.向AgCl悬浊液中加入足量的NaI溶液,无明显现象产生
D.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均降低
第Ⅱ卷
必考部分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com