
题目列表(包括答案和解析)
7.下列说法不正确的是
A.碳原子之间可以形成单键、双键和叁键,还可以形成环状结构
B.淀粉、油脂、蛋白质在一定条件下都能发生水解反应
C.甲烷和乙烯两种气体可用溴水鉴别
D.实验室仅用乙醇和乙酸混合加热来制取乙酸乙酯
6.科学发展观的要义之一是“可持续发展”,下列做法与这一要义不吻合的是
A.我国规定自 2008年6月1日起,商家不得无偿提供塑料袋,以减少白色污染
B.强化垃圾回收和综合利用机制,加大对垃圾发电的政策支持
C.我省沿海地区应加速开发风能和潮汐能,减少化石能源的消耗
D.实验室未经处理的废液不能任意排放,要集中转移到安全地带排放
31.[化学-有机化学基础]
已知: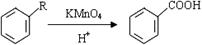
下图为一系列有机物的相互转化关系,其中B和C按1∶2反应生成Z,F和E按1∶2反应生成W,W和Z互为同分异构体。
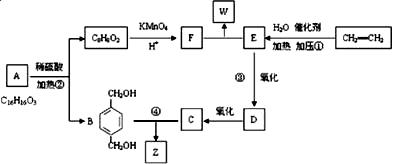
回答下列问题:
(1)写出反应①和④的反应类型: 、 。
(2)写出A中含氧官能团的名称: 、 。
(3)1 mol F最多可与 mol NaOH溶液反应。
(4)写出③的化学反应方程式: 。
(5)与B互为同分异构体,属于酚类且苯环上只有两个互为对位取代基的化合物有4种,其结构简式为:
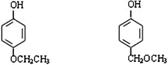
, 。
30.
|
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满。请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为 < < (填元素符号)。
(2)E元素基态原子的电子排布式为 。
(3)X和Z形成有毒气体XZ,实验室常用EQ溶液吸收并定量测定XZ的含量。反应时,XZ与EQ形成配合物的分子中原子间成键关系如下图所示:
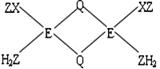
E+和之间的化学键类型是 ;
(4)XZ2分子中含有 个π键。
(5)Z氢化物的沸点比Q氢化物的沸点高,理由是 。
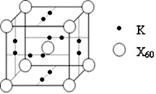
(6)X元素可形成X60单质,它与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),该化合物中X60与钾原子个数比为 。
25.研究性学习小组为探究Cu与浓H2SO4反应及其产物SO2的性质,设计如下实验装置:
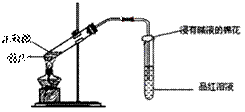
(1)写出铜与浓硫酸反应的化学方程式: ;
浸有碱液的棉花的作用是 。
(2)该小组同学在实验中发现以上实验装置有相当多不足之处,如实验不够安全和易造成环境污染等。为改进实验和更多地了解SO2的性质,经过同学间的讨论和与老师的交流,设计了如下实验装置。
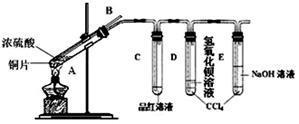
①对试管A中的浓H2SO4和铜丝进行加热,发现E试管中有气泡逸出,品红溶液很快褪色,但最终未见D试管中氢氧化钡溶液出现浑浊。为探究D试管中未出现浑浊的原因,该小组同学在化学手册中只查阅到下列物质常温下的溶解度数据:
|
物质 |
溶解度(g/100水) |
物质 |
溶解度(g/100水) |
|
Ca(OH)2 |
0.173 |
Ba(OH)2 |
3.89 |
|
CaCO3 |
0.0013 |
BaSO3 |
0.016 |
|
Ca(HCO3)2 |
16.60 |
|
|
他们应用类比研究方法预测了D试管未出现浑浊的原因: 。
②为验证D试管中溶液的组成,进行了下列实验,请你帮他们完成实验报告。
|
实验方案 |
现象 |
|
1.取少量溶液于试管中,加入氢氧化钠溶液 |
|
|
2.取少量溶液于试管中,加入稀盐酸,加热,用湿润的蓝色石蕊试纸检验生成的气体。 |
|
(3)实验结束后,发现试管A中还有铜片剩余。该小组的同学根据所学的化学知识认为硫酸也有剩余。下列药品中能够用来证明反应结束后的试管A中确有余酸的是 (填写字母编号)。
A.铝粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(4)请写出长导管B的作用 (只写一点就可)。
24.利用天然气合成氨的部分工艺流程示意图如下:
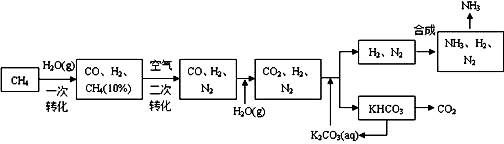
依据上述流程,完成下列问题:
(1)写出流程中一次转化的化学方程式: 。
(2)上述流程有二处循环,一是K2CO3(aq)循环,二是 循环(填化学式)。
(3)1998年科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解法合成氨。写出阳极电极反应式: 。
(4)一定温度下,将a mol N2与b mol H2的混合气体通入容积为 2 L的密闭容器中,发生反应: N2(g)+ 3H2(g)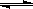 2NH3(g);△H<0。达到平衡时,测得n(N2)= 13 mol ;n(NH3)= 6 mol。
2NH3(g);△H<0。达到平衡时,测得n(N2)= 13 mol ;n(NH3)= 6 mol。
①该反应平衡常数的表达式:K = ;
②达到平衡时N2的转化率为 ;
③为了提高H2的转化率,可采取的措施是 。
A.增大的H2浓度 B.增大的N2浓度 C.使用催化剂 D.降低温度
23.X、Y、Z是三种常见的单质。
(1)若X、Y、Z的组成元素为不同短周期非金属元素。常温下,X为淡黄色固体,X在Z中充分燃烧可生成B,B是形成酸雨的主要物质之一,A与B反应生成固体X和C,C在常温下为无色液体。
①写出A的化学式: ;
②写出氢氧化钠溶液中通入少量的B反应的化学方程式: ;
③在298K、101 kPa时,已知:
A(g) +1/2Z(g)=== C(l)+ X(s);△H1 =-288.93 kJ·mol-1
A(g) +3/2Z(g)=== C(l)+ B(g); △H2 =-586.16 kJ·mol-1
写出反应X+Z→B的热化学方程式: 。
(2)若X、Y、Z的组成元素为同一短周期金属元素,且原子序数依次增大。X、Z最高价氧化物对应的水化物之间能发生反应。
①写出Y组成的元素原子结构示意图: ;
②写出X、Z最高价氧化物对应的水化物之间反应的离子方程式: ;
③列举一例Z在生活、生产中的用途: 。
12.铅蓄电池是典型的可充电电池,在现代生活中有着广泛的应用,其充电、放电按下式进行:
Pb + PbO2 +
2H2SO4 2PbSO4
+ 2H2O,有关该电池的说法正确的是
2PbSO4
+ 2H2O,有关该电池的说法正确的是
A.放电时,蓄电池内电路中H+向负极移动
B.放电时,每通过1mol电子,蓄电池就要消耗2molH2SO4
C.充电时,阳极反应:PbSO4 +2e-→Pb+SO42-
D.充电时,铅蓄电池的负极与外接电源的负极相连
第Ⅱ卷
11.下列溶液中离子浓度的关系正确的是
A.0.10 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(OH-)+c(HCO3-+c(CO32-)
B.0.1 mol·L-1 NaHA溶液,其pH等于4:c(HA-)>c(H+)>c(H 2A)>c(A2-)
C.将足量AgCl固体分别放入5 mL水和10 mL 0.1mol·L-1的NaCl溶液中溶解至饱和,溶液中Ag+浓度前者大于后者
D.相同温度下,pH=12的NaOH溶液和pH=12的CH3COONa溶液中,水的电离程度前者大于后者
10.在指定环境中,下列各组离子一定可以大量共存的是
A.使pH试纸呈红色的溶液:Fe2+、NO3-、SO42-、Na+
B.常温下,在c(H+)/c(OH-) = 1×1012的溶液:NH4+、Mg2+、C1-、K+
C.加入铝粉放出氢气的溶液:Na+、Cl-、NH4+、NO3-
D.使无色酚酞试液显红色的溶液:S2-、K+、HCO3-、Al3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com