
题目列表(包括答案和解析)
31.[化学-有机化学基础]
工业合成UV高级油墨的主要成份的路线图如下:
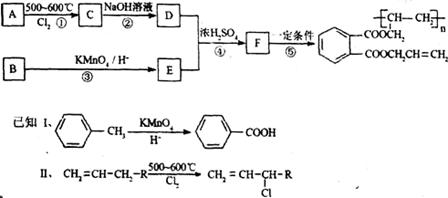
请回答:
(1)A的结构简式为 。
(2)下列有关D的说法,正确的是 。(填序号)
A.能使:紫色石蕊试液变红 B.能发生缩聚反应
C.能发生取代反应 D.能发生加成反应
(3)F的官能团有 种(不含苯环)。lmol F与氢氧化钠溶液共热,最多能消耗NaOH mol。
(4)反应②的化学方程式为 。
(5)E有多种同分异构体,写出同时符合以下条件的局分异构体的结构简式 。
①与NaHCO3反应能生成CO2气体
②与新制氢氧化铜悬浊液共热能生成砖红色沉淀
③苯环上的一氯代物只有两种同分异构体
30.
|
第四周期元素的单质及化合物在工农业生产中应用广泛。
(1)第四周期元素中,基态原子的最外层只有1个电子的元素共有 种。
(2)铂丝蘸取氯化钙在酒精灯上灼烧,火焰呈现砖红色,显色原因是 (填序号)。
A.氯化钙受热挥发 B.氯化钙受热分解
C.钙离子中电子跃迁 D.氯离子中电子跃迁
(3)无水硫酸铜呈白色,吸水后形成胆矾,呈蓝色。科学家通过X射线舅定出胆矾的结构,其结构可用右图表示。
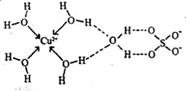
①胆矾晶体中除共价键、配位键及微弱的范德华力外,还存在的两种作用力是 和 。
②铜离子形成胆矾中配位离子的离子方程式为 。
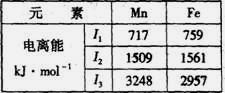
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如右表。据表判断Mn2+和Fe2+再失去-个电子的难易,并从原子结构的角度筒述其原因 。
25.二甲醚(CH3OCH3)和甲醇(CH,OH)被称为 2l世纪的新型燃料。以CH4和H2O为原料铡备二甲醚和甲醇的工业流程如下:
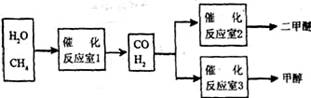
请填空: ‘
(1)在一定条件下,反应室l中发生反应:CH4(g)+H2O(g)
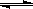 CO(g)+3H2(g);ΔH>0
CO(g)+3H2(g);ΔH>0
在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。将1.0 mol CH4和2.0 mol H2O(g)通入反应室l(假设容积为 100 L),l0 min末有0.1 mol CO生成,则10 min内反应的平均速率v(H2) 。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方 程式为
。
(3)在压强为0.1 MPa条件下,反应室3(容积为V L)中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g), CO的转化率与温度、压强的关系如下图。
CH3OH(g), CO的转化率与温度、压强的关系如下图。
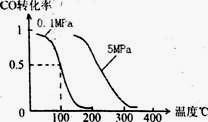
①该反应的△H (填“<”、“>”或“=”)。
② 100℃时该反应的平衡常数K= (用含a、V的代数式表示)。
③在其它条件不变的情况下,反应室3再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”),平衡常数 (填“增大”、“减小”或“不变”)。
24.纯碱是工业生产和日常生活中的重要物质。某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究。请填空:
方案一:纯碱样品 测定剩余固体质量
测定剩余固体质量
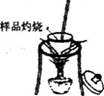
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分加热(如右图)。坩埚中发生反应的化学方程式为
。
(2)将坩埚置于干燥器中冷却后称量。实验时需要重复“加热一冷却一称量”操作多次,其目的是 。
方案二:纯碱样品溶液 测定沉淀质量
测定沉淀质量
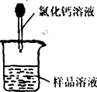
(3)称取m 1g样品,置于小烧杯中,加水溶解。向小烧杯中滴加足量氯化钙溶液(如右图)。将反应混和物过滤后的下一步操作是 。
(4)沉淀经干燥后称量为m 2g,则该样品中碳酸钠的质量分数为 。
(5)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际 (填“偏高”、“偏低”或“不变”)。
方案三:纯碱样品 测定生成CO2的质量
测定生成CO2的质量
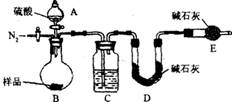
(6)本实验采用右图装置,C中盛放的物质是 。
(7)反应前后都要通入N2,反应后通入N2的目的是 。
23.W、X、Y、Z是原子序数依次增大的同一短周期元素,W是金属元素,X是地壳中含量最多的金属元素,且w、x的最高价氧化物的水化物相互反应生成盐和水;Y、Z是非金属元素,Y与W可形成离子化合物WY;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子。
(1)X的原子结构示意图为 。
(2)W、X的最高价氧化物的水化物相互反应的离子方程式为 。
(3)工业上制取X单质的化学方程式为 。
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐溶液中,离子浓度由大到小的顺序为 。在催化剂作用下,汽车尾气中G的氧化物GO与一氧化碳两种气体能相互反应转化为无污染、能参与大气循环的两种气体,若有 33.6 L(已换算成标准状况)一氧化碳参加反应,转移的电子数为 mol。
(5)298K时,Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到Z的最高价氧化物的水化物的稀溶液,并放出a kJ的热量。该反应的热化学方程式为 。
12.常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液叙述正确的是
A.溶液中由水电离产生的H+浓度为1×10-7 mol/L
B.c(CH3COO-) + c(CH3COOH)-c(Na+) = 0.05 mol/L
C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度
D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
第Ⅱ卷
11.用NA代表阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,11.2 LH2气体的中子数为2NA
B.常温下, 23 g乙醇中共价键数为3.5NA
C.25℃时,l L pH=13的氢氧化钾溶液含有0.1 NA个氢氧根离子
D.在氧气作为氧化剂的反应中,1 mol O2获得的电子数一定为4NA
10.X、Y、Z、W四种短周期元素在周期表中相对位置如表所示,Y、Z质子数之和为21,下列说法中不正确的是
|
B.X、Y、W的氢化物中,Y的氢化物沸点最高
C.Z的阳离子与Y的阴离子电子层结构相同
D.W元素的简单离子半径大于Z元素的简单离子半径
9.下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是
A.Mg2+、Na+、SO42-、Cl- B.K+、CO32-、Cl-、NO3-
C.Na+、K+、NO3-、SO32- D.NH4+、Na+、SO42-、NO3-
8.下列实验操作或结果正确的是
A.将水沿着烧杯内壁缓缓加入浓硫酸中,用玻璃棒不断搅拌
B.将20gKNO3完全溶于80 mL水中,配制质量分数约为20%的KNO3溶液
C.用广泛pH试纸测得某溶液的pH为3.3
D.分液时,将下层液体和上层液体先后从分液漏斗的下口放出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com