
题目列表(包括答案和解析)
25.(共14分)
(1)碳碳双键………………………………………………………………………… 2分
(2)CH3CH=CHCOOH 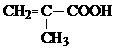 ………………………各2分,共4分
………………………各2分,共4分
(3)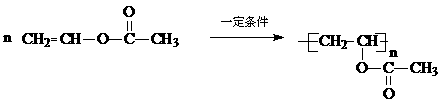 …………2分
…………2分
(4)CH3CHO………………………………………………… …………………… … 2分
(5)  …………………………………………………………… 2分
…………………………………………………………… 2分
(6) 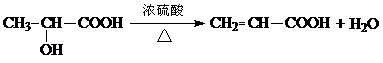 2分
2分
2.化学方程式不写条件、少箭头均扣1分,不重复扣分;不配平不得分。是可逆反应的不写可逆符号扣1分,不得负分。
1.合理答案均可酌情给分,但不得超过原题分数。
5.C 6.D 7. B 8.B 9.D 10.C 11. B 12. A
关于25题-28题的说明:
28.(共15分)
某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2 中的几种均匀混合而成,取样品进行如下实验(部分产物略去):

(1)Z的分子式是 。
(2)在实验②中观察到的现象是“沉淀部分溶解”。为进一步确定X的组成,向实验②后的溶液中滴加过量的氨水,有沉淀生成,写出生成沉淀的离子反应方程式为 ,则沉淀X含有的物质的化学式为 、 、 。
(3)取滤液Y,测得其pH > 7,向其中滴入硫酸钠溶液,未观察到任何现象,则滤液Y中一定含有的含氧酸根离子是(用离子符号表示) 、 ,由此推测“将过量的气体Z通入滤液Y中”的实验现象是 。
(4)上述推断可见,实验①中能反应的物质之间的物质的量的比例关系为(用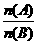 形式表示)
形式表示)
、 。
化学二模答案
27.(共15分)
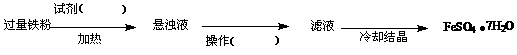
铁是一种历史悠久、应用最广泛、用量最大的金属。某实验小组用铁粉进行如下实验。
(1)取少量纯铁粉与足量的稀硫酸反应,在不影响产生氢气总量的情况下,若要加快反应速率,可行的方法有(填序号) 。
① 加热 ② 滴加少量浓硝酸 ③ 滴加少量硫酸铜
(2)甲同学欲用少量纯铁粉与足量浓硫酸反应得到硫酸亚铁。同学们认为不论常温还是加热的条件下均不可行,理由是
。
大家讨论后将上述方案做如下改进后可获得FeSO4·7H2O,请填写下列括号中的空白:
(3)乙同学在实验室中用m g废铁屑(已除去表面的油污)与足量稀硫酸反应,准确测定反应生成氢气的体积,实验数据记录如下:
|
气体体积/mL |
10 |
20 |
30 |
|
所用时间/s |
30 |
85 |
165 |
若用每秒产生的气体体积(mL)表示该反应的速率,则30 s至85 s内该反应的速率为 。若完全反应后测得产生气体的体积为V mL (已折算成标准状况),则该废铁屑中铁的质量分数为(用含m、V的代数式表示) 。
若实验操作无误,但测得铁的质量分数总是大于实际值,原因可能是 。
26.(共16分)
|
|
|
|||
|
D |
|
|
|
|
|
|
|
W |
|
|
已知W、D、E、X、Y、Z是六种短周期主族元素。元素W与元素Y位于同一主族。X、W、E三元素位于同一周期,且原子序数依次增大。D、W在周期表中的位置如右图。请回答下列问题。
(1)① 请在右图中用元素符号标明E的位置。
②化合物DY2 和 DW2 的分子空间构型相似,DW2的结构式为 。
③已知元素W和E的最外层电子数之和与Y和X的最外层电子数之和相差6,W、E、X、Y中的三种元素形成化合物水解呈碱性的离子方程式为(任写一种) 。
④已知aX、bY、cZ三种元素,a + b + c=26,Z的最高价氧化物的水化物与其氢化物反应生成化合物的晶体类型为 。
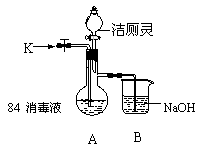 (2)有媒体报道:“洁厕灵(含无机酸)和84消毒液(主要成分为次氯酸钠和氯化钠)混和使用会使人中毒”。为验证此报道,某实验小组利用如图装置(夹持装置略去)进行实验。
(2)有媒体报道:“洁厕灵(含无机酸)和84消毒液(主要成分为次氯酸钠和氯化钠)混和使用会使人中毒”。为验证此报道,某实验小组利用如图装置(夹持装置略去)进行实验。
① 关闭M处止水夹,从分液漏斗滴入洁厕灵,观察到烧瓶中有黄绿色气体E2生成,该反应的离子方程式为 。
② 关闭分液漏斗的旋塞,打开M处止水夹,从K 处鼓入空气至烧瓶中气体的颜色呈无色,该操作的目的是
。
(3)化合物XZ3是合成抗禽流感药物“达菲”的中间活性物质,XZ3 受撞击会生成一种非金属单质和一种离子化合物X3Z,请写出该反应的化学方程式 。若反应生成标准状况下11.2 L气体单质,则电子转移的物质的量为 mol。
25.(共14分)
有机物高分子化合物A常用做木材的粘合剂,俗称“白乳胶”。B通过加聚反应可制得A。B的蒸气对H2的相对密度为43,分子中C、H、O的原子个数之比为2∶3∶1。B在酸性条件下水解可生成碳原子数相同的两种有机物D和M。
(1)B分子中非含氧的官能团的名称为 。
(2)B的同分异构体中属于不饱和羧酸的有3种,它们是CH2=CHCH2COOH、
、 。
(3)写出B在一定条件下生成A的化学方程式 。
(4)通常羟基与双键碳原子直接相连接时,易发生下列转化:
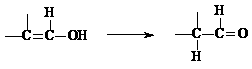
M能发生银镜反应,请写出M的结构简式 ;
(5)已知:
D可以发生如下转化关系: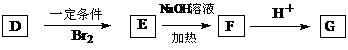
有机物N与G互为同系物,且N的相对分子质量比G大14,写出两分子N在一定条件下生成六元环状化合物的结构简式 。并写出N发生消去反应的化学方程式 。
12.一定条件下,将X和Y两种气体按不同比例放入固定容积的密闭容器中,反应达平衡后,测得X、Y的转化率与起始时物质的量之比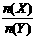 的关系如图1。改变温度和压强,生成物Z的百分含量如表1,则该反应的化学方程式可表示为
的关系如图1。改变温度和压强,生成物Z的百分含量如表1,则该反应的化学方程式可表示为
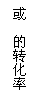

|
温度/℃ |
压强/kPa |
Z的质量分数 |
|
200 |
101 |
0.40 |
|
300 |
101 |
0.48 |
|
400 |
202 |
0.52 |
|
400 |
303 |
0.52 |
|
A.3X(g)+Y(g) 4Z(g);ΔH>0
4Z(g);ΔH>0
B.X(g) +
3Y(g) 4Z(g);ΔH>0
4Z(g);ΔH>0
C.3X(g)+Y(g) 3Z(g);ΔH<0
3Z(g);ΔH<0
D.X(g)+3Y(g) 3Z(g);ΔH<0
3Z(g);ΔH<0
11.氰化物有剧毒,我国工业废水中氰化物(CN-)的最高允许排放浓度为0.5 mg/L;对废水中CN-的处理方法是:在碱性条件下,用Cl2将废水的中CN-转化成N2和CO2等,使废水得到净化。发生的反应为:2CN- + 8OH-+ 5Cl2 = 2CO2 ↑+ N2 ↑+10 Cl-+ 4H2O 。下列有关说法正确的是
A.上述反应中氧化产物只有N2
B.经测定,NaCN的水溶液呈碱性,说明CN-能促进水的电离
C.若上述反应生成0.4 mol CO2,则溶液中阴离子增加的物质的量为2 mol
D.现取1 L含CN-1.02 mg/L的废水,至少需用4.0×10-5mol Cl2处理后才符合排放标准
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com