
题目列表(包括答案和解析)
20.已知0.25molCH4完全燃烧生成液态水时放出222.5kJ 热量,则下列热化学方程式中正确
的是 ( )
A.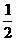 CH4(g)+O2(g)=
CH4(g)+O2(g)= 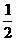 CO2(g)+H2O(1); △H=-445kJ/mol
CO2(g)+H2O(1); △H=-445kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(1); △H=+890kJ/mol k+s-5#u 
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g); △H=-890kJ/mol
D.CH4(g)+2O2(g)=CO2(g)+2H2O(g); △H=+890kJ/mol
19.已知热化学方程式:
①H2(g)+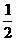 O2(g)=H2O(g); △H=-241.8kJ·mol-1
O2(g)=H2O(g); △H=-241.8kJ·mol-1
②2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ·mol-1
③H2(g)+ 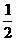 O2(g)=H2O(1); △H=-285.8kJ·mol-1 k+s-5#u
O2(g)=H2O(1); △H=-285.8kJ·mol-1 k+s-5#u

④2H2(g)+O2(g)=2H2O(1); △H=-571.6kJ·mol-1
则氢气的燃烧热为 ( )
A.241.8kJ·mol-1 B.483.6kJ·mol-1 C.285.8kJ·mol-1 D.571.6kJ·mol-1
18.把7.40g NaHCO3和Na2CO3·10H2O混合物溶于水制成100ml溶液,其中c(Na+)=0.600mol/L,若将等质量的该混合物固体加热至恒重,则该混合物的质量减少( )
A.3.18g B.4.22g C.5.40g D.无法确定
17.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为 ( )
A.1: 1: 1 B.2: 2 : 1 C.2: 3: 1 D.4: 3: 2
16.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低k+s-5#u

C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
15.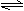 对反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g);△H<0 ( )
对反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g);△H<0 ( )
A.该反应化学反应速率关系是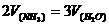
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态k+s-5#u

C.达到化学平衡状态,若增加容器体积,则正反应速率减小,逆反应速率增大
D.若温度降低,达到新的化学平衡时,NO的体积分数将增大
14. 可逆反应2SO2(g)+O2(g) 2SO3(g)在一定的温度下反应达平衡,各物质的量之比为:n(SO2): n(O2): n(SO3)=2 : 3 : 4,若缩小容器的体积,当反应再次达平衡时各物质的量为:n(O2)=0.8mol、n(SO3)=1.4mol此时SO2的物质的量为 ( )
可逆反应2SO2(g)+O2(g) 2SO3(g)在一定的温度下反应达平衡,各物质的量之比为:n(SO2): n(O2): n(SO3)=2 : 3 : 4,若缩小容器的体积,当反应再次达平衡时各物质的量为:n(O2)=0.8mol、n(SO3)=1.4mol此时SO2的物质的量为 ( )
A.0.4mol B.0.6mol C.0.8mol D.1.2mol
13. 一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g);△H<0,达到平衡后测得A气体的浓度为0.5mol/L;当恒温下将密闭容器的容积扩大两倍并再次达到平衡时,测得A的浓度为0.3mol/L。则下列叙述正确的是 ( )
一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g);△H<0,达到平衡后测得A气体的浓度为0.5mol/L;当恒温下将密闭容器的容积扩大两倍并再次达到平衡时,测得A的浓度为0.3mol/L。则下列叙述正确的是 ( )
A.平衡向右移动 B.x+y>z C.B的转化率提高 D.C的体积分数增加
12.不能比较出金属M比金属N的还原性强的是 ( )
A.M+与N2+离子的电子层结构均与氩原子相同k+s-5#u

B.M原子的最外层电子数比N原子少
C.M能从N的可溶性的盐溶液中置换出N
D.M、N在电解质溶液中构原电池,M做负极
11.下列离子方程式正确的是 ( )
A.过量的Cl2通入FeBr2溶液中
2Cl2+2Fe2++2Br- 4Cl-+2Fe3++Br2
B.过量的CO2通入NaAlO2溶液中
CO2+H2O+AlO2- Al(OH)3↓+HCO3-k+s-5#u

C.在溶液中NH4HSO3与NaOH等物质的量混合
NH4++HSO3-+2OH- SO32-+NH3↑+2H2O k+s-5#u

D.碳酸钠溶液中滴加少量的盐酸溶液
CO32-+2H+
CO2↑+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com