
题目列表(包括答案和解析)
4. 原子结构的表示方法
⑴原子结构示意图:表示原子的核电荷数和核外电子在各电子层上排布的图示;
⑵电子式:用“«”或“Δ在元素符号周围表示最外层电子的图示。
3. 核外电子排布规律
⑴每一电子层最多容纳的电子数为2n2;
⑵最外层电子数最多不超过8个,若K层为最外层,电子数最多不超过2个;
⑶次外层电子数最多不超过18个;
⑷倒数第三层最多容纳的电子数为32个;
⑸电子能量低的离原子核近,电子能量高的离原子核远。
2. 人们把具有一定数目的质子和一定数目的中子的一种原子叫做核素。同一元素的不同核素之间互称同位素。
同位素的特征:⑴同一元素的各种同位素质量数不同化学性质几乎完全相同。⑵在天然存在的某种元素里,不论是游离态还是化合态,各种同位素所占的原子个数百分比一般是不变的。
1. 原子的组成 ⑴ 质子数=核电荷数=核外电子数=原子序数
⑵ 质量数(A)=质子数(Z)+中子数(N)
19. W:C2H2 X:H2O2 Y:Na2O2 Z:Na2S


18.⑴O N S
H ⑵NH4+ + H2O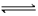 NH3·H2O + H+
NH3·H2O + H+
⑶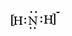 讲析:A、B、C在周期表中有四种可能的位置关系,经讨论计算,A为O,B为N,C为S时符合题意。
讲析:A、B、C在周期表中有四种可能的位置关系,经讨论计算,A为O,B为N,C为S时符合题意。
17. ①三 IA 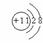 ②H2CO3 、NaOH、
②H2CO3 、NaOH、
Al(OH)3 、H2SO4、HClO4
③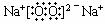 2Na2O2+2CO2
= 2Na2CO3+O2
2Na2O2+2CO2
= 2Na2CO3+O2
④ Al(OH)3 Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
16. X-n X+m X-m X+n 85 55 讲析:若A、B同在第IA族相邻时,两者原子序数相差上一周期元素种类;若A、B同在第VIIA族相邻时,两者原子序数相差下一周期元素种类。
15.⑴ N ③; ⑵ Sn ④; ⑶ Fe ①
10.BC 11.A 12.C 13.BD 14.D
讲析:1.氢元素也可以得到1个电子表现出-1价,与卤素的性质相似,故而可排在VII族。 2.由题意可知X为Si,单质为原子晶体符号题意 4.在A、B、C.D四种元素中,同周期的两元素原子序数之和为2x,又因同主族各周期的元素之间原子序数相差8、18或32。所以四种元素中,同主族的两元素的原子序数之和为2x或 2x+10或 2x+14。所以四种元素的原子序数之和可能为: 4X、4X+10、4X+14三种情况。 5.逐一代入讨论,选项C符合题意。 6. 相同物质的量的原子获得相同物质的量的电子时释放出的能量越多,该原子越活泼,形成的离子越稳定。 7.最外层电子数小于6且是2的整数倍的元素是Si。 8.定位讨论得A为C、B为Mg、C为Si。 9.符合选项B的化合物可以是HCHO,选项C可以是HCOOH, 选项D则可以是H2CO3。 11.相邻两主族的原子序数之差必为奇数。 12.镭是第IIA族中金属性最强的元素,氢氧化镭为强碱。 13. 第七周期排满时的最后一种元素为稀有气体元素,但也能与其它物质发生化学反应。 14.分析A的化合价可能是+2和+4,故选项D符合题意。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com