
题目列表(包括答案和解析)
9.注意对燃烧热及中和热的概念要点的理解。
典型题点击:
8.反应热的简单计算及比较:
①反应物各物质的物质的量与反应热成正比例;
②反应热等于生成物总键能减去生成物总键能;
③某种物质的状态或晶型不同会引起反应热的差异,计算时可将热化学方程式进行“加减”后,根据反应过程的反应热比较大小。
7.热化学方程式:表明反应所放出或吸收的热量的化学方程式。书写时的注意点:
①要注明反应物和生成物的聚集状态,因为物质呈现哪一种聚集状态,与它们所具有的能量有关。即:反应物的物质相同、状态不同、△H也不同。
②要注明反应温度和压强(若为同素异形体,要注明名称)。因为△H的大小和反应的温度、压强有关。如不特别注明,即表示在101KPa和25℃。
③热化学方程式中的计量数不表示分子个数,而是表示物质的量,故化学计量数可以是整数,也可以是分数,相同物质的化学反应,当化学计量数改变时,其△H也同等倍数的改变。
④△H表示:在热化学方程式中△H的“+”与“-”一定要注明,“+”代表吸热,“-”代表放热。
6.能源、材料和信息被称为人类社会发展的三大支柱。
能源是指提供能量的自然资源,它分为常规能源(如水能、
煤炭、石油、天然气、核燃料等),新能源(如太阳能、风能、生物能、潮汐能等)。能源的利用,其实就是能量的转化过程,物质内部的能量越低,则该物质越稳定,根据反应热,可比较物质内部能量高低。
5.发生的条件:有难溶的或难电离的或挥发性的物质
生成,只要具备上述条件之一,复分解反应就能发生。
4.重视置换反应的一般规律:金属置换金属(应记住金属活动性顺序)、金属置换非金属、非金属置换金属(一般在高温下进行)、非金属置换非金属。注意某些反应的特殊性:最活泼的K、Ca、Na等在溶液(酸除外)中,必定是先与水反应;金属与强氧化性酸发生的不是置换反应,不能生成H2;F2在水溶液中只发生F2与H2O的置换反应。
3.熟悉四种无机基本类型反应的定义、特点。判断四种
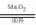 无机基本反应的类型时,要由反应前后物质的种类共同确定,只看反应物或生成物的种类是片面的,易导致误判。如生成物是一种单质和一种化合物的反应:
无机基本反应的类型时,要由反应前后物质的种类共同确定,只看反应物或生成物的种类是片面的,易导致误判。如生成物是一种单质和一种化合物的反应:
2KClO3 2KCl + 3O2↑,Fe +CuSO4 = FeSO4 + Cu,既可能是分解反应也可能为置换反应。
2.掌握化学反应的四种基本类型:化合、分解、置换、复分解.
1.从不同的视角了解化学反应的分类方法,全面而准确地掌握化合、分解、置换、复分解这四种隶属于初中课本内容的反应,并能应用于判断新颖而复杂的化学反应的类型。
23.(1)2:5 (2)7mol/L (3) 1:3
(4)5Fe+14HNO3=5Fe(NO3)2+NO2↑+3NO↑+7H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com