
题目列表(包括答案和解析)
8. (黄山市田家炳实验中学2008年高三第三次月考)离子检验的常用方法有三种:
(黄山市田家炳实验中学2008年高三第三次月考)离子检验的常用方法有三种:
|
检验方法 |
沉淀法 |
显色法 |
气体法 |
|
含义 |
反应中有沉淀产生或溶解 |
反应中有颜色变化 |
反应中有气体产生 |
下列离子检验的方法不合理的是( )
A. NH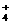 -气体法 B. I
-气体法 B. I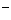 -沉淀法 C. Ca
-沉淀法 C. Ca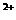 -气体法 D. Fe
-气体法 D. Fe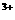 -显色法
-显色法
7. (安徽师大附中2008-2009学年度第一学期期中考试高三化学)用一定量的铁与足量的CuO制单质铜,有人设计了以下两种方案:
(安徽师大附中2008-2009学年度第一学期期中考试高三化学)用一定量的铁与足量的CuO制单质铜,有人设计了以下两种方案:
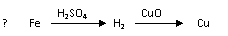
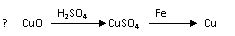
若按实验原则进行操作,则两者制得单质铜的量为 ( )
A.一样多 B.①多 C.②多 D.无法判断
6.(安徽省包集中学2009届高三11月月考)为确定某溶液的离子组成,进行如下实验:①.测定溶液的pH,溶液显强碱性。②.取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。③.在上述②溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。④.取③ 中上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验以下推测正确的是 ( )
A.一定有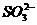 离子
B.不一定有
离子
B.不一定有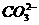 离子
离子
C.不能确定 离子是否存在
D.不能确定
离子是否存在
D.不能确定 离子是否存在
离子是否存在
4.(怀远二中2008-2009学年高三第四次月考)下列实验操作或所记录的数据合理的是( )
A.NaOH溶液可保存在玻璃塞的试剂瓶中
B.液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中
C.一学生用广泛pH试纸测得某浓度的稀盐酸pH为2.3
D.配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉
5.(怀远二中2008-2009学年高三第四次月考)清蒸大闸蟹由青色变成红色,一同学认为这种红色物质可能象酸碱指示剂一样,遇到酸或碱颜色会发生改变。就这位同学的看法而言,这应该属于科学探究中的
A.实验 B.假设 C.观察 D.分类
3.下列的实验操作中所用仪器合理的是 ( )
A. 用25 mL的碱式滴定管量取14.80 mL NaOH溶液
B. 用100 mL量筒量取5.2 mL盐酸
C. 用托盘天平称取25.20 g氯化钠
D. 用150 mL容量瓶配制150 mL 0.1 mol / L盐酸
2. 用酒精灯加热时,需要垫石棉网的仪器有 ( )
① 烧杯 ② 坩埚 ③ 锥形瓶 ④ 蒸发皿 ⑤ 试管 ⑥ 烧瓶
 A. ②④⑤
B. ①②③
C. ④⑤⑥
D. ①③⑥
A. ②④⑤
B. ①②③
C. ④⑤⑥
D. ①③⑥
1.下列仪器中,没有“0”刻度的是 ( )
 A. 量筒 B. 温度计 C. 酸式滴定管 D. 托盘天平游码刻度尺
A. 量筒 B. 温度计 C. 酸式滴定管 D. 托盘天平游码刻度尺
17. (1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。
该反应中还原产物是______;若反应过程中转移了0.3 电子,则氧化产物的质量是______
电子,则氧化产物的质量是______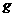 。
。
(2)将a mol Cl2 通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:
2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,写出另2个可能发生的离子方程式
① 当 a / b =1时____________________________________________;
② 当a / b≥3/2时____________________________________________。
③ (3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3 +H2O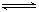 Al(OH)4- + H+ ②NH3+H2O
Al(OH)4- + H+ ②NH3+H2O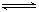 NH4+ + OH_
NH4+ + OH_
(A)已知B(OH)3是一元弱酸,试写出其电离方程式__________________________________
(B)N2H4是二元弱碱,试写出其第二步电离方程式____________ ____
16.(1)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+= __CO2+__Mn2++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
 ①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为
mol;
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为
mol;
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由 变为 。该溶液中还原剂的物质的量为 mol;
 ③原试样中H2C2O4·2H2O和KHC2O4的质量分数分别是多少?
③原试样中H2C2O4·2H2O和KHC2O4的质量分数分别是多少?
(请列式计算,写出运算过程)
15. 某化学兴趣小组利用实验室提供的下列试剂:铁粉、0.1mol·L-1FeCl3溶液、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+ 、Fe3+ 的氧化性、还原性,并对实验结果加于应用。
(1)根据氧化还原的有关原理,兴趣小组对Fe2+、Fe3+ 的氧化性、还原性提出了如下2种假设:
假设一:Fe2+ 既有还原性又有氧化性;
假设二:Fe3+ 具有氧化性;
 (2)设计实验方案,进行实验并描述实验现象,完成下列表格。
(2)设计实验方案,进行实验并描述实验现象,完成下列表格。
|
探究内容 |
实验方案 |
实验现象 |
|
探究Fe2+具有还原性 |
取少量0.1mol·L-1FeCl2溶液,加入足量新制氯水后,再往溶液中加入少量KSCN溶液 |
|
|
探究Fe3+具有氧化性 |
|
|
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了一个反应事实:FeCl2 + Zn = ZnCl2 + Fe
该反应的离子方程式为:
(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com