
题目列表(包括答案和解析)
7. 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入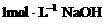 溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
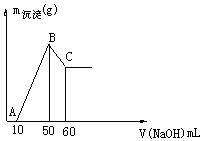
求:(1)镁铝合金的质量组成。
(2)盐酸的物质的量浓度。
(3)B点沉淀的质量。
参考答案
6.粉末状试样A是一种含有少量某钾盐(白色或无色)和一种活泼金属组成的混合物。进行如下实验:
①将A和适量CuO粉末混合均匀,放在一置于三角架的石棉网上,用酒精灯加强热,可看到混合物迅猛燃烧,白光耀眼。完全反应后得到混合物B。
②向冷却的混合物B中加入稀盐酸至沉淀不再溶解,恰好用去HCl 0.6mol,得到溶液C(设溶液体积为1000mL)和沉淀D,然后过滤。
③将溶液C加强热、蒸干、灼烧,得到固体E,且E的质量和A的质量恰好相等。
④如果向溶液C中逐滴加入NaOH溶液,则会出现白色沉淀且逐渐增多,继续滴加NaOH溶液白色沉淀又会逐渐减少,最后完全消失。
请填空:
(1)写出①中可能的三个反应的化学方程式 ;
; 。
(2)A中金属的质量为 ;所含钾盐的物质的量为 。
(3)写出④中先后反应的离子方程式 , 。
5.下列物质中既能与稀硫酸反应,又能与氢氧化钠溶液反应是
(1)NaHCO3 (2)(NH4)2S (3)Al2O3 (4)Al (5)Al(OH)3
A. (3) (4) B.(3)(4)(5) C.(1)(3)(4)(5) D.全部
4. 由锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是
A. 锌 B.铁 C.铝 D.镁
3. 下列离子方程式正确的是
A.稀硫酸与氢氧化钡溶液反应H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.硫酸铝溶液中滴入氨水Al3++3OH-=Al(OH)3 ↓
C.碳酸氢镁溶液中加入氢氧化钠溶液Mg2++2HCO3-+4OH-=Mg(OH)2↓+CO32-+2H2O
D.硝酸铝溶液中滴加少量的氢氧化钠溶液Al3++3OH-=Al(OH)3 ↓
2. 下列各组离子在溶液中可以大量共存,且加入氨水后也不产生沉淀的是
A.Na+ Ba2+ Cl- SO42- B.K+ AlO2- NO3- OH-
C.H+ NH4+ Al3+ SO42- D.H+ Cl- CH3COO- NO3-
1.下列金属晶体中,金属离子和自由电子的相互作用最弱的是:
A.钠 B.钾 C.镁 D.铝
6. 解:由于铁过量,且硫酸在反应过程中会不断变稀,故发生的反应方程式为:
Fe + 2H2SO4(浓) = FeSO4 + SO2↑+ 2H2O Fe + H2SO4 = FeSO4 + H2↑
且物质间物质的量存在如下的关系:Fe - 2H2SO4 - SO2 Fe - H2SO4 - H2
 依题意可知: n(SO2) + n(H2)
= 11.2 L÷22.4 L · mol-1 = 0.5 mol
依题意可知: n(SO2) + n(H2)
= 11.2 L÷22.4 L · mol-1 = 0.5 mol
n(SO2)×64 g · mol-1 + n(H2)×2 g · mol-1 = 19.6 g
解得:n(SO2)=0.3 mol n(H2)=0.2 mol
⑴c(H2SO4)=(0.30 mol×2 + 0.20 mol)÷0.05 L = 16.0 mol · L-1
⑵剩余m(Fe)=30.0 g-56 g · mol-1×(0.30 mol + 0.20 mol) = 2.0 g
⑶能反应 2Fe2+ + Cl2 = 2 Fe3+ + 2Cl-
n(Cl2)=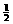 n(Fe2+)=0.25 mol
n(Fe2+)=0.25 mol
2010年高考化学第二轮复习20分钟专题突破(9)
专题 铝及其化合物
1.C 2.B 3.A 4.C 5.C
6. 将30.0 gFe粉(过量)与50.0 mL浓硫酸在加热条件下充分反应,共收集到11.2 L(标况)气体(设生成的气体全部逸出),其质量为19.6 g。试计算:
⑴浓H2SO4的物质的量浓度
⑵反应后剩余铁粉的质量
⑶判断反应后的所得溶液能否与氯气反应?如能,请写出反应的离子方程式并计算所需氯气的物质的量;如不能,请说明理由。
参考答案
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com