
题目列表(包括答案和解析)
1. D 2.C 3.D 4.D 5.C 6.D
8.(9分)在一定温度下,将8 molSO2和4 molO2放入密闭容器内进行反应:
2SO2(g)
+ O2(g)  2SO3(g)
2SO3(g)
(1)如果原容器内的压强为3×106 Pa,平衡时SO2的转化率为80%,求平衡时容器内的压强.
(2)如果平衡时混合气体中SO2所占的体积百分数为60%,求SO2平衡时的物质的量.
参考答案
7.(12分)在一固定容积的密闭容器中,保持一定条件下进行以下反应:X(气)+2Y(气) 3Z(气),已知加入1 molX和3 molY。达到平衡后,生成a mol Z。
3Z(气),已知加入1 molX和3 molY。达到平衡后,生成a mol Z。
(1)在相同实验条件下,若在同一容器中改为加入2 molX和6 molY,达到平衡后,Z的物质的量为 。
(2)在相同实验条件下,若在同一容器中改为加入2 molX和8 molY,若要求在反应混合气体中Z体积分数不变,则还需加入Z的物质的量为 。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加入 mol Y,
mol Z,才能使平衡时Z为0.9 a mol。
6.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)。某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)。某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应
5.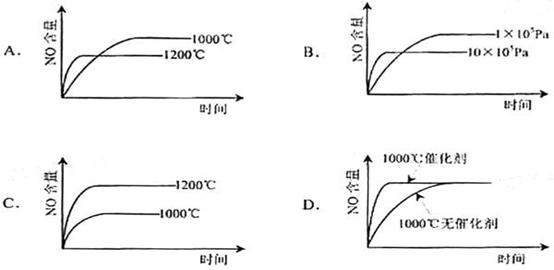 已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g).
△H= -1025KJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g).
△H= -1025KJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4. 将固体NH4I置于密闭容器中,在一定温度下发生下列反应:① NH4I(s)= NH3(g)+HI(g) ②2HI(g) =H2(g)+I2(g)达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应 ①的平衡常数为
A.9 B.16 C.20 D.25
3.能够充分说明在恒温下的密闭容器中反应:2SO2+O2 2SO3,已经达到平衡的标志是( )
2SO3,已经达到平衡的标志是( )
A.容器中SO2、O2、SO3共存 B.容器中SO2和SO3的浓度相同
C.容器中SO2、O2、SO3的物质的量为2︰1︰2 D.容器中压强不随时间的变化而改变
2.在m
A(g) + n B(g)  p C(g) + q D(g)的反应中,(m.n.p为各物质的化学计量数),经5min达到平衡,测得:A增加3 mol·L-1,B增加1 mol·L-1,C减少2
mol·L-1,此时若给体系加压,平衡不移动,则m :n
:p :q为( )
p C(g) + q D(g)的反应中,(m.n.p为各物质的化学计量数),经5min达到平衡,测得:A增加3 mol·L-1,B增加1 mol·L-1,C减少2
mol·L-1,此时若给体系加压,平衡不移动,则m :n
:p :q为( )
A.2 :3 :2 : 3 B.2 :2 :3 : 3
C.3 :1 :2 : 2 D.3 :1 :2 : 3
1.在不同条件下,分别测得反应2SO2+O2  2SO3的速率如下,其中最快的是( )
2SO3的速率如下,其中最快的是( )
A.v(SO3) = 4 mol·L-1·min-1 B.v(O2) = 2 mol·L-1·min-1
C.v(SO2) = 5 mol·L-1·min-1 D.v(SO2) = 0.1 mol·L-1·S-1
6. (1) Cl2(g)+ P(s)= PCl3(g) △H =-306kJ/mol
Cl2(g)+ P(s)= PCl3(g) △H =-306kJ/mol
(2)PCl5(g)= PCl3(g)+ Cl2(g) △H =93kJ/mol
25% 大于
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解
(4)-399kJ/mol 等于
(5)PCl3+4H2O=H3PO4+5HCl
2010年高考化学第二轮复习20分钟专题突破(21)
专题 化学反应速率与化学平衡
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com