
题目列表(包括答案和解析)
3.(1)根据题意,n(CO2)=n(BaCO3)= =0.06 mol
=0.06 mol
若CO2全部来自CaCO3的分解,则m(CaCO3)=0.06 mol×100 g / mol=6.00 g>5.78 g,不合题意,所以,A中一定含有MgCO3。
(2)m(CO2)=0.0 6mol×44 g / mol=2.64 g
m(H2O)=2.82 g-2.64 g=0.18 g
n[Mg(OH)2]=n(H2O)=0.18g/18g.mol =0.01 mol
=0.01 mol
m[Mg(OH)2]=0.01 mol×58 g / mol=0.58 g
n(CaCO3)+n(MgCO3)=0.06 mol
n(CaCO3)×100 g / mol+n(MgCO3)×84 g / mol+0.58 g=5.78 g
解得:n(MgCO3)=0.05 mol,n(CaCO3)=0.01 mol
 ×100%=82.3%
×100%=82.3%
tt2010年高考化学第二轮复习20分钟专题突破(30)
专题 化学与技术
2.(1)根据题意,n(HCl)=12 mol / L×0.2 L=2.4 mol
n(MnO2)= =0.2 mol
=0.2 mol
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
n(HCl)︰n(MnO2)=2.4︰0.2=12︰1>4︰1
所以浓盐酸过量,应根据MnO2计算。
根据制备氯气的化学方程式
 n(Cl2)=n(MnO2)=0.2 mol
n(Cl2)=n(MnO2)=0.2 mol
又因为2Cl2+2Ca(OH)2=CaCl2 +Ca(ClO)2+2H2O n[Ca(ClO)2]=n(Cl2)=0.1 mol
m[Ca(ClO)2]=143 g / mol×0.1 mol=14.3 g
(2)① 随着反应进行,温度升高,会产生副产物Ca(ClO3)2
6Cl2+6Ca(OH)2 5CaCl2 +Ca(ClO3)2+6H2O
② Cl2未与石灰乳完全反应,残余氯气被NaOH溶液吸收,
Cl2+2NaOH=NaCl+NaClO+H2O
5CaCl2 +Ca(ClO3)2+6H2O
② Cl2未与石灰乳完全反应,残余氯气被NaOH溶液吸收,
Cl2+2NaOH=NaCl+NaClO+H2O
1. (1)设稀释后溶液的H+物质的量浓度为c(H+),依溶液电中性,有:(3.20g÷64g/mol)×2+c(H+)×1.00 L=0.200 mol/L×1.00L,解得c(H+)=0.100 mol/L,pH=-lgc(H+)=1
(2)设n(NO2)=a mol,n(NO)=b mol,依电子得失守恒,有:a+3b=0.100 ①
依N元素守恒,有:a+b=0.030B-0.200 ②
解①②联立得:a=(0.045B-0.350)mol,b=(0.150-0.015B)mol
(3)依题意有不等式:n(NO2)>0,n(NO)>0,n(NO2)≥n(NO),即:0.045B-0.350>0,解得B>7.80;0.150-0.015B>0,解得 B<10.0;0.045B-0.350≥0.150-0.015B,解得 B≥8.30;综合上述结果得:8.3≤B<10。
3. 水垢可以看作由多种物质组成的混合物,为研究含有Ca2+、Mg2+、 的水所形成的水垢的化学组成,取干燥的水垢6.32 g ,加热使其失去结晶水,得到5.78
g 剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到的11.82 g沉淀。
的水所形成的水垢的化学组成,取干燥的水垢6.32 g ,加热使其失去结晶水,得到5.78
g 剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到的11.82 g沉淀。
(1)通过计算确定A中是否含有碳酸镁;
(2)5.78 g剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重2.82 g,通过计算确定A中各成分的物质的量,并计算出水垢中碳酸盐质量分数。
参考答案
2. 较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应。某校甲、乙两化学研究性学习小组均用200 mL 12 mol / L盐酸与17.4 g MnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀氢氧化钠溶液吸收残余的氯气。分析实验结果发现:① 甲、乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值,② 甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca(ClO3)2的含量较高。试回答下列问题:
(1)上述实验中理论上最多可制得Ca(ClO)2多少克?
(2)实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因,并写出可能涉及到的化学方程式。
(2)Cu2O;CuO比Cu2O的热稳定性差
t2010年高考化学第二轮复习20分钟专题突破(29)
专题 化学计算题
1. 将3.20g Cu溶于B mol/L过量的硝酸溶液30.0 mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所剩溶液加水稀释至1000 mL,测得c(NO3-)=0.200 mol/L。
(1)试求稀释后溶液的pH。
(2)生成的气体中NO2和NO的物质的量(可以含有B的代数式表示)。
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO2+2NaOH=2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,试讨论B的取值范围。
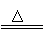
(2)3CuO+2NH3 3Cu+N2+3H2O
3. (一)2NH4Cl + Ca(OH)2 ===== CaCl2+2NH3↑+2H2O
(2)NaOH固体或生石灰或碱石灰等
(3)否; 氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大
2. (1)放出大量的热 2Na2O2+2H2O 4NaOH+O2↑
(2)将带火星的木条放在P口处,木条复燃
将Q口插入到盛水的烧杯中,有气泡产生
(3)MnO2 使带火星的木条复燃
(4)①B 防止倒吸 ②500mL
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是
种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
;
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量为72g。据此可推得,A的化学式为 。由此,得到的结论是
参考答案
1. (1)MnO2+4H++2C1- Mn2++C12↑+2H2O
(2)A C D
(3)Ⅱ Ⅲ Ⅰ
(4)8NH3+3C12 6NH4C1+N2
将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取秒量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+
(5)将导气管与G口连接,另一端插入盛有NaOH溶液的烧杯中
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com