
题目列表(包括答案和解析)
6.下列各组溶液中,不用任何其他试剂就能鉴别的是 ( )
A.Na2SO4 H2SO4 AlCl3 BaCl2
B.HCl NaOH K2SO4 NaHSO4
C.HCl KHCO3 aCl NaHSO4
D.NaOH FeCl3 MgCl2 K2SO4
5.同温同压下,燃烧20 mL H2S用去15 mL O2,则充分燃烧的H2S与不充分燃烧的H2S的质量之比为 ( )
A.1∶2 B.2∶3
C.4∶3 D.3∶7
4.下列物质中既能与H2S反应,又能与溴水反应的是 ( )
A.FeSO4溶液 B.Na2S溶液
C.CuSO4溶液 D.氯水
3.下列有关硫化氢性质的说法正确的是 ( )
A.给盛硫化氢的容器加热会产生黄色物质
B.由于硫化氢弱酸性,所以久置的氢硫酸会变浑浊
C.硫化氢具有强还原性,故氢硫酸在反应中只能作还原剂
D.氢硫酸是弱酸,无法通过复分解反应制取强酸
2.碲元素及其化合物不可能具有的性质是 ( )
A.碲的化合价有-2价、+4价、+6价
B.碲的氧化物有TeO2和TeO3
C.碲能与氢气直接化合,且H2Te比H2Se稳定
D.单质碲呈银白色,还原性比硒强
1.下列有关酸雨的说法不正确的是 ( )
A.二氧化碳是形成酸雨的主要原因
B.形成酸雨的主要原因是大量燃烧含硫的化石燃料
C.酸雨的pH小于5.6
D.减少酸雨产生可采取的措施是对燃料进行脱硫
22.(8分) 有三种不同质量比的氧化铜与炭粉的混合物样品①②③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的质量。
(1)甲取样品①强热,若所得固体为金属铜,将其置于稀硝酸中微热,产生1.12 L气体(标准状况),则样品①中氧化铜的质量为_________g。
(2)乙取样品②a g强热,生成的气体不能使澄清的石灰水变浑浊。将反应后的固体于足量的稀硝酸中微热,充分反应后,有b g固体剩余,该剩余固体的化学式为_________。样品②中氧化铜的质量为_________g(以含a、b的代数式表示)。
(3)丙称量样品③强热后剩余的固体质量比原样品减少了c g,若该固体为金属铜,则样品③中氧化铜的物质的量(n)的取值范围为_________。k+s-5#u 
21.(8分)环保检测部门测定某气体样品中含一氧化碳的含量,其方法和实验步骤如下:
①将2.000 L的气体样品通过盛有I2O5固体的加热管,发生的反应为:
5CO+I2O5 5CO2+I2。
5CO2+I2。
②将所产生的碘升华,并加入30.00 mL 0.005 0 mol·L-1的硫代硫酸钠溶液,发生的反应为:
I2+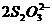 ====2I-+
====2I-+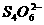
③将②中溶液取出,加入1.000 mL 0.010 0 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
试计算1 L该气体样品中有多少毫克(mg)的CO。k+s-5#u

20.(6分)根据锡、铅的主要化合价及其稳定性,以化合价升降的观点进行分析,完成下列填空:
(1)锡的+2价化合物应具有较强的____性,铅的+4价化合物应具有较强的____性。
(2)已知Sn2+的还原性比Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强,试写出下列反应的化学方程式:k+s-5#u

①氯气与锡共热_____;
②氯气与铅共热_____;
③把棕色的PbO2投入亚硫酸溶液中充分反应,可观察到棕色PbO2逐渐变成白色固体物质______。
19.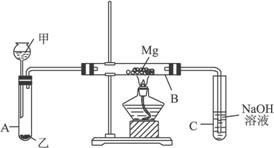 (9分)已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。
(9分)已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。
Ⅰ.用如图所示装置进行Mg与SO2反应的实验。
(1)选择制取SO2的合适试剂_________________。
①10%的H2SO4溶液 ②80%的H2SO4溶液 ③Na2SO3固体 ④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式__________________________ 。装置C中NaOH溶液的作用是__________________。
(3)你认为该装置是否有不足之处?__________。如果有,请一一说明______________。
Ⅱ.某研究小组进行了“实验室制Si”的研究,他们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si。
②Mg在点燃的条件下即可与SiO2反应。
③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4 k+s-5#u

④Si和SiO2均不与稀H2SO4反应。
⑤SiH4在空气中自燃。
他们在研究报告中记载着:“选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(4)该小组“实验室制Si”的化学方程式是___________________________。
(5)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com