
题目列表(包括答案和解析)
5.仅用一种试剂鉴别如下物质:苯、CCl4、NaI溶液、NaCl溶液、Na2SO3溶液,下列试剂中不能选用的是 ( )
A.溴水 B.FeCl3溶液
C.酸性KMnO4溶液 D.AgNO3溶液
4.CO2气体中含少量SO2,将此混合气体通过下图所示的装置,可得到干燥纯净的CO2,则甲、乙两瓶中所装的试剂是 ( )
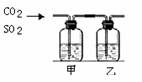
|
|
甲 |
乙 |
|
A |
NaOH溶液 |
浓硫酸 |
|
B |
浓硫酸 |
NaOH溶液 |
|
C |
饱和的NaHCO3溶液 |
浓H2SO4 |
|
D |
浓硫酸 |
饱和的Na2CO3溶液 |
3.下列实验能达到预期目的是 ( )
A.除去苯中的苯酚,加饱和NaHCO3溶液再分液
B.向CuSO4溶液中加入稍过量的NaOH溶液,得到Cu(OH)2悬浊液,再加入适量蔗糖加热有红色沉淀生成,说明蔗糖分子结构中有醛基
C.取醋酸钠溶液,用PH试纸检验,试纸变蓝,说明醋酸是弱酸
D.将淀粉溶液和食盐溶液混合装入半透膜,浸入纯水中,过一段时间,取半透膜内的液体滴入碘水呈蓝色,说明利用渗析可提纯胶体
2.关于某溶液所含离子的检验方法和结论都正确的是 ( )
A.加入BaCl2溶液,有白色沉淀生成,加稀盐酸沉淀不消失,则原溶液一定有SO42-
B.加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失,则原溶液中不一定有Cl-
C.加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中一定有CO32-或SO32-
D.加入NaOH溶液并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液中一定含有NH4+
1.用下列实验装置进行的实验中,能达到相应实验目的的是 ( )

A.装置甲:在石墨电极上有氢气生成 B.装置乙:检验NaCl中的Na+
C.装置丙:向试管中滴加液体 D.装置丁:验证HCl气体在水中的溶解性
21.(9分)硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4∶1):
3FeS2 + 8O2 = Fe3O4 + 6SO2 ①
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 ②
(1)含硫35%的硫铁矿样品(杂质不含硫),其FeS2的含量为_________________。
(2)设1 t纯净的FeS2按②式完全反应,产生标准状况下SO2__________ m3。
 (3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,所得炉气中SO2的体积分数为多少?
(3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,所得炉气中SO2的体积分数为多少?
(4)480 g纯净的FeS2在空气中完全反应,若所得固体中,
Fe和O的物质的量之比n(Fe)∶n(O) =4∶a,
此时消耗空气为bmol。
①试写出b与a的关系式:___________________。
20.(10分)铁在冷的浓硫酸中能发生钝化。某兴趣小组同学发现将一定量的铁与浓硫酸加热时,铁完全溶解,得到溶液A,并产生大量气体B。实验室现有下列试剂: 0.01 mol/L酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分,并将有关实验操作、预期现象和结论填入下列表格中。
[提出猜想]
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 中的一种或两种。
Ⅲ.任意写出一个铁与浓硫酸加热时,可能发生的有关反应方程式
[实验探究]
|
|
实验操作 |
预期现象 |
结 论 |
|
验证猜想Ⅰ |
步骤①:取少量溶液A,滴入0.01 mol/L酸性KMnO4溶液 |
|
|
|
步骤②: |
|
含有Fe3+ |
|
|
验证猜想Ⅱ |
将所得气体B通入如下图装置 |
|
含有两种气体 |
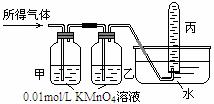
[问题讨论]
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,请对该观点进行评价: 。
19.(10分)减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的,利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:
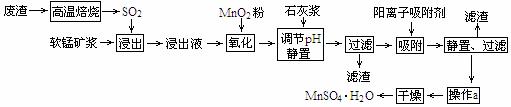
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、
Pb2+等其他金属离子。(提示:①在工业上,用沉淀法不能完全除去的离子还可以用 吸附法除去②有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表③阳离子 吸附剂吸附金属离子的效果见下图。④已知PbO2的氧化性大于MnO2。)
|
离子 |
离子半径(pm) |
开始沉淀pH |
完全沉淀pH |
|
Fe2+ |
74 |
7.6 |
9.7 |
|
Fe3+ |
64 |
2.7 |
3.7 |
|
Al3+ |
50 |
3.8 |
4.7 |
|
Mn2+ |
80 |
8.3 |
9.8 |
|
Pb2+ |
121 |
8.0 |
8.8 |
|
Ca2+ |
99 |
- |
- |

请回答下列问题:
(1)写出浸出过程中主要反应的一个化学反应方程式 ,
氧化过程中主要反应的一个离子反应方程式 。
(2)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至 。
(3)决定阳离子吸附剂吸附效果的因素是 (填写序号)。
a.溶液的pH b.金属离子的电荷
c.金属离子的半径 d.吸附时间
(4)操作a包括 过滤、洗涤等过程。
18. (15分)以黄铁矿为原料生产硫酸的工艺流程图如下:
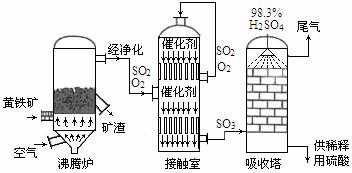
(1)将燃烧黄铁矿的化学方程式补充完整 :4
+11O2
:4
+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160gSO3气体与H2O化合放出260.6kJ的热量,该反应的热化学方程是 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是 。
② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果;
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是 %; 若铵盐质量为15.00g。 浓硫酸增加的质量为 。 (计算结果保留两位小数)
17.(8分)某待测溶液(阳离子为Na+)中可能会有SO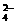 、S2-、SO
、S2-、SO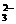 、Cl-、Br-、NO
、Cl-、Br-、NO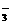 、CO
、CO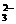 、HCO
、HCO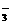 中的一种或若干种。进行下列实验(如下图所示)(每次实验所加试剂均过量):
中的一种或若干种。进行下列实验(如下图所示)(每次实验所加试剂均过量):
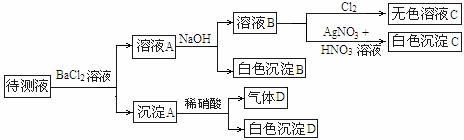
回答以下问题:
(1)待测液是否含有SO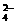 、SO
、SO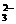 ?答:
?答:
(2)沉淀B的化学式为 。
(3)根据以上实验,待测液中肯定没有的离子是 ,肯定存在的离子是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com