

题目列表(包括答案和解析)
4.今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(m mol),在乙瓶中加入少量的NaHSO3晶体(m mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度大小关系是(溶液体积变化忽略不计) ( )
A.甲=乙>丙 B.甲>丙>乙 k+s-5#u 
C.丙>甲=乙 D.乙>丙>甲
3.碘是原子半径较大的卤族元素,可能呈现金属性,下列事实能说明这个结论的是 ( )
A.已制得了IBr、ICl等卤素互化物
B.已经制得I2O5等碘的氧化物
C.已经制得I(NO3)3、I(ClO4)3·2H2O等含I3+的化合物k+s-5#u 
D.I2易溶于KI等碘化物溶液,形成I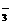
2.已知HIO既能和盐酸又能和KOH发生中和反应,则它与盐酸反应的产物是 ( )
A.IO- B.H2O C.HI D.ICl
1.氯气可用来消灭田鼠,为此将氯气通过软管灌入洞中,这是利用了Cl2下列性质中的( )
①黄绿色 ②密度比空气大 ③有毒 ④较易液化 ⑤溶解于水
A.①②③ B.②③ C.③④ D.③④⑤k+s-5#u

21.[解释](1)①中,CuSO4粉末是验证有水存在的试剂;②使B中CuO反应充分,就必须减慢氢气的生成速率,使氢气和CuO充分接触发生反应。
(2)①可以参照CO2与过氧化钠的反应加以改写;④SO2为大气污染物,多余的气体要进行尾气吸收。
答案:(1)①验证H2的还原性并检验其氧化产物k+s-5#u
②控制分液漏斗的活塞,使稀H2SO4缓慢滴人(或在烧瓶中加水或将烧瓶放入冰水中或用冰毛巾捂着烧瓶或加入醋酸钠固体等,其他合理答案亦可给分)检验装置中空气是否排尽或检验氢气是否纯净
(2)①2SO2+2Na2O2 2Na2SO3+O2↑
②A→D→B→C(2分)淡黄色固体粉末逐渐变为无色
③将一带火星的木条置于装置末端出气口,看木条是否复燃k+s-5#u
④接装置C(1分)理由是:接装置C既可防止空气中的水蒸气进入与B中的过氧化钠反应,又可吸收过量的SO2,防止污染空气(或答:接D将不能吸收多余的SO2或接E将不能防止水蒸气进入且不利于O2的检验或其他合理答案)
20.解析:(1)在本实验中,利用的是氨气的简易制法:将氨水逐滴加到NaOH固体或碱石灰上,放出大量的氨气;(2)中反应为氯气的实验室制法;(3)为了得到纯净、干燥的氯气,应该将气体先通入饱和食盐水,除去氯化氢杂质,后通过浓硫酸,除去水蒸气;(4)因为氨气和氯气的密度相差较大,这样处理可以使两者混合均匀。
答案:(1)2NH4Cl+Ca(OH)2△====CaCl2+2NH3↑+2H2O e h k+s-5#u
(2)MnO2+4HCl(浓)△====MnCl2+Cl2↑+2H2O (3)g 除去氯气中的水蒸气
(4)让密度较小的氨气上浮,密度较大的氯气下沉,有利于它们充分混合发生反应
(5)c(Cl-)>c(NH+4)>c(H+)>c(OH-) (6)3Cl2+NH3=== NCl3+3HCl
19.[解释](1)原理是:药片中的碳酸钙和盐酸反应后,利用NaOH溶液滴定滴定剩余盐酸的量,既可以计算出碳酸钙的含量;在操作时,①和②的顺序可以颠倒。
答案:(1)①②④③②④③或②①④③②④③
(2)A、C; 烧杯、玻璃棒
(3)CaCO3+2HCl=CaCl2+CO2↑+H2O NaOH+HCl=NaCl+H2O
(4)0.125-0.0025(v1+v2)
18.解析:(1)在实验室制取乙烯时,应将温度迅速上升到170℃;乙烯的密度和空气相近,所以应该用排水法收集气体;
(2)乙烯和二氧化硫均能使酸性高锰酸钾褪色,所以,检验乙烯的生成,必须事先除去二氧化硫气体。
答案:(1)
|
A |
没有使用温度计控制温度 |
E |
无 |
|
B |
没有检验二氧化硫完全除去的品红溶液 |
F |
无 |
|
C |
使用排空气法不正确,应用排水法 |
G |
无 |
|
D |
尾气处理装置多余 |
H |
无 |
(2)答案:a. A B A D
b.装置①中品红溶液褪色 c.除去二氧化硫气体,以免干扰乙烯的性质实验
d.检验二氧化硫是否被除尽
e.装置③中的品红溶液不褪色,装置④中的高锰酸钾酸性溶液褪色
17.解析:成套装置包括反应装置,检验装置和尾气处理装置。C中加入浓硫硫和木炭作为反应物的发生器,产物中必须先检验水,因为在检验其他物质时会在其它试剂中混入水,可选用装置B,放入无水硫酸铜,若变蓝则说明有水。接着检验SO2气体,用装置A,放入品红检验,若品红褪色,则说明有SO2气体产生,再用装置A,放入酸性KMnO4溶液以除去SO2,然后再用装置A,放入品红,检验品红是否除尽,因为CO2是用澄清石灰水来检验的,而SO2也可以使澄清石灰水变浑,故先要除去SO2。
答案:
C 浓硫硫和木炭 产生反应物
B 无水硫酸铜 检验是否有水
A 品红 检验SO2
A 酸性KMnO4 除去SO2
A 品红 检验SO2是否除尽k+s-5#u
A 澄清石灰水 检验CO2的存在。
16.解析:A项中,不能用润湿的PH试纸测溶液的PH;E中,①②会造成所配浓度偏低,③对浓度无影响。F中,证明淀粉已水解,应该向水解液中加入氢氧化钠溶液中和硫酸到碱性,再加入银氨溶液水浴加热一段时间,观察现象;G中,溴水即能和二氧化硫反应,也能和乙烯发生加成反应。
答案:BCD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com