
题目列表(包括答案和解析)
4.37g的Na2O2晶体和42g的Na2O晶体中阴阳离子的个数比是 ( )
A.1:1 B. 1:2 C.5:4 D.6:5 k+s-5#u

3.实验室里需要配制480mL 0.10mol·L-1的硫酸铜溶液,下列实验方案及实验操作正确的是 ( )
|
|
容量瓶容积 |
溶质质量 |
实验操作 |
|
A |
480mL |
硫酸铜:7.68g |
加入 500mL水 |
|
B |
480mL |
胆矾:12.0g |
配成500mL溶液 |
|
C |
500mL |
硫酸铜:8.0g |
加入500mL水 |
|
D |
500mL |
胆矾:12.5g |
配成500mL溶液 |
2.NA代表阿伏加德罗常数,下列叙述错误的是 ( )
A.10ml质量分数为98%的H2SO4,用水稀释至100ml,H2SO4质量分数为9.8% k+s-5#u 
B.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g k+s-5#u

D.一定温度下,1L 0.5mol/LNH4Cl溶液与2L 0.25mol/LNH4Cl溶液所含NH4+物质的量
不同
1.下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不记)。其中能表示等质量的氢气与氦气的是 ( )
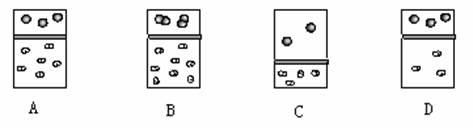
k+s-5#u 
20.(9分)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密
度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为
。k+s-5#u

(2)所得溶液中Cl-的物质的量为 mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
19.(12分)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I-作用定量析出I2,I2溶于过量的KI溶液中:
I2+I-==I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63- k+s-5#u

析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I3-==S4O62-+3I-。
准确称取ag胆矾试样,置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液。
①实验中,在加KI前需加入少量NaF,推测其作用可能是
②实验中加入,你认为硫酸的作用是
③本实验中用碘量瓶而不用普通锥形瓶是因为:
④硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:
⑤根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=
18.(12分)碘酸钾是一种白色晶体粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物制质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氢酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:

6I2+11KClO3+3H2O
6KH(IO3)2+5KCl+3Cl2 k+s-5#u

试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为 ;
(2)步骤②中,用硝酸而不用HI,其原因可能是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)实验中涉及两次过滤,在实验室进行过滤实验中,用到的玻璃仪器有 ;
(5)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为: ;
(6)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
17.(12分)三氯化磷和五氯化磷的物理常数如下表。
|
|
熔点 |
沸点 |
|
三氯化磷 |
-122℃ |
76℃ |
|
五氯化磷 |
148℃ |
200℃分解 |
用下图所示装置(酒精灯、铁架台等未画出)制取三氯化磷,在俱支试管d中放入足量白磷,将Cl2迅速而又不间断地通入d中,氯气与白磷会发生反应,产生火焰。k+s-5#u

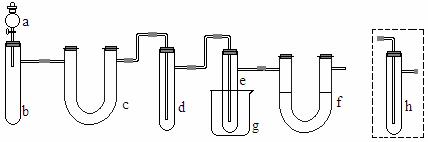
图中,a,b应该装入的试剂或药品分别是浓盐酸和二氧化锰,在b仪器处加热。请据此回答下列回答:
(1)在俱支试管e中收集生成的三氯化磷,为保证三氯化磷蒸气冷凝,应在烧杯g中加入 。
(2)三氯化磷遇到水蒸气强烈反应,甚至发生爆炸,所以d,e仪器及装入其中的物质都不能含有水分。为除去Cl2中的水分,c中应装入 作干燥剂。
(3)实验室将白磷保存于水中,取出的白磷用滤纸吸干表面水分,浸入无水酒精中片刻,再浸入乙醚中片刻即可完全除去水分。解释用上述方法除去水分的原因是 。
(4)f装置中应装入
,目的是
。能否用h代替,为什么?
。k+s-5#u

16.(10分)) 海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:
①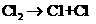 ②
②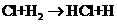
③ ……
……
反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属于
键(填“极性”或“非极性”)。
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是
(用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
b.卤化氢的键长按H-F、H-C1、H-Br、H-I的顺序依次减小k+s-5#u

c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
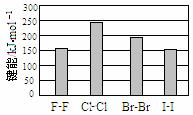 (4)卤素单质的键能大小如右图。由图推断:
(4)卤素单质的键能大小如右图。由图推断:
①非金属性强的卤素,其单质分子的化学键
断裂(填“容易”或“不容易”或“不一定容易”)。
②卤素单质键能大小与键长的关系为:
15.向50gFeCl3溶液中放入一小块钠,待反应完全后,过滤,得到仍有棕黄色的溶液45.9g,则投入钠的质量为 ( )
A.4.6g B.4.1g C.6.9g D.9.2g k+s-5#u

第II卷(选择题,共55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com