
题目列表(包括答案和解析)
3.对反应Zn+2HNO3+NH4NO3=N2↑+3H2O+Zn(NO3)2的下列说法中正确的是 ( )
A.N2只是还原产物,Zn(NO3)2只是氧化产物
B.NH4NO3只是氧化剂,Zn是还原剂
C.反应申生成1 mol N2时共有5 mol电子转移k+s-5#u
D.HNO3在反应中没有表现出酸性k+s-5#u
2.下列变化过程中所发生的反应一定属于氧化还原反应且放热反应的是 ( )
A.皂化反应 B.铝热反应 k+s-5#u
C.中和反应 D.可逆反应
1.化学反应中通常伴随着能量变化,下列说法中错误的是 ( )
A.煤燃烧时将部分化学能转化为热能
B.电解熔融Al2O3时将部分化学能转化为电能k+s-5#u
C.TNT爆炸时将部分化学能转化为动能
D.镁条燃烧时将部分化学能转化为光能k+s-5#u
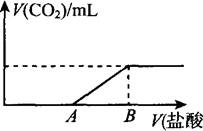
20.(10分)标准状况下,向100 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
 k+s-5#u
k+s-5#u

已知图中B点位置固定,V(B)=300 ml。,而点A、C可在各自的轴上移动。
(1)原溶液的物质的量浓度为 mol/L,B点时,最终所得溶液中的溶质的物质的量浓度是 mol/L。(两种溶液混合时体积可以直接相加)。
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
|
V(A)的取值 |
V(A)=0 |
0<V(A)<150 |
V(A)=150 |
150<V(A)<300 |
|
溶质的成分 |
① |
② |
③ |
④ |
(3)取V(A)=100 mL时对应的溶液M 30 mL与等体积的l mol/L的盐酸按各种可能的方式混合,产生的气体体积V mL,则V的取值范围是 。
19.(15分)纯碱、烧碱等是重要的化工原料。
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 。若其它操作不变,将A与C连接,可观察到的现象是 。k+s-5#u 

(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3 g白色固体,该白色固体的组成是 (写化学式)。
设计实验确认该白色固体中存在的阴离子,试完成下列方案。
|
实验操作 |
实验现象 |
结论 |
|
|
①
取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 |
|
|
|
|
②
过滤,取2 mL滤液于试管中 |
|||
|
③ |
|
|
|
(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下: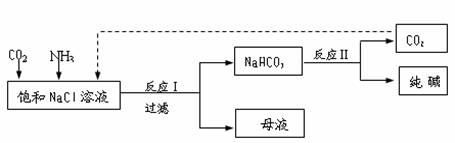 k+s-5#u
k+s-5#u

已知NaHCO3在低温下溶解度较小。反应I为:
NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,处理母液的两种方法如下。
NaHCO3↓+NH4Cl,处理母液的两种方法如下。
① 向母液中加入石灰乳,可将其中 循环利用,同时得到融雪剂 。
② 向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。
试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式:_______________________________________。
18.(8分)三种短周期元素X、Y、Z两两之间可形成原子个数比均为1:1的三种化合物A、B、C。已知A、B均为离子晶体,构成A晶体的阴离子X-和构成B晶体的阳离子Z+分别与He和Ne具有相同的核外电子排布,常温下,A、B与水都能发生剧烈反应,分别生成无色气体R和W;由X、Y两元素组成的化合物C的水溶液中加入少量MnO2,也发生剧烈反应,放出气体W。据此回答:
(1)Y是 (填元素名称)
(2)向C的水溶液中滴入紫色石蕊试液充分振荡后石蕊试液褪色,说明C具有 性。
(3)化合物B的电子式为
(4)写出A与水反应的化学方程式
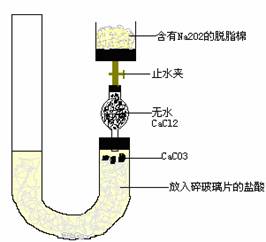
17.(16分)有人设计一个Na2O2与CO2反应实验装置图如下:
 k+s-5#u
k+s-5#u

打开止水夹,发现CO2通过裹有Na2O2的脱脂棉,可观察到脱脂棉剧烈燃烧起来.
(1)由实验现象所得出的有关Na2O2与CO2反应的结论是:
a:有氧气生成:b:
(2)甲、乙两位同学各称取质量为m g的过氧化钠与二氧化碳反应后的样品,并用下图所示仪器测定样品的组分。
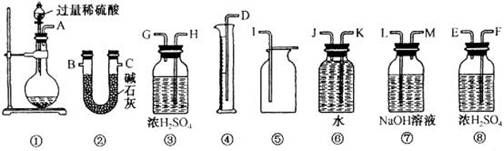
请回答下列问题:
①甲同学通过实验测得的数据是氧气的体积,该同学读取实验数据时应注意冷却至室温、____________、眼睛视线与凹液面最低处相切。
②乙同学通过连接仪器①②进行实验,他测得的数据是 。按他测得的数据计算出的实验结果偏高,理由是 。
③为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口的连接顺序
。k+s-5#u

④按③设计的实验装置进行实验,若测得实验前后装置②的质量分别是w1 g和w2 g,则样品中碳酸钠的质量分数为 。
⑤在③的改进装置中由于受到仪器的局限,是否也有不足之处 (若没有,此空不必回答;若有,请一并说出不足的理由) 。
16.(6分)某未知溶液X中可能含有K+、Fe2+、NH4+、Cl-。检验其中是否含有K+,通常有如下两套实验方案。
方案一:焰色反应法
用洁净的玻璃棒蘸取未知液X置于酒精灯外焰上灼烧,观察到火焰呈黄色,则证明其中不含K+。对上述实验过程中的错误和疏漏之处加以纠正、补充: 、
。
方案二:亚硝酸钴钠法
在CH3COOH酸化的溶液中,K+与亚硝酸钴钠[Na3Co(NO2)6]反应生成黄色沉淀[K2NaCo(NO2)6],该原理可用于K+的检验。注意:NH4+也能与Na3Co(NO2)6生成黄色沉淀,会干扰K+离子的检验。请你利用上述反应原理设计一个实验方案,检验未知溶液X中是否含有K+。
。
15.我国拥有世界上最大的稀土矿,品位甚高。以RE表示稀土元素,可以向含RE的硫酸盐溶液中加入粉状Na2SO4使稀土元素转为沉淀,反应为
|
( )
A.该反应为复分解反应 B.该反应一定在强碱性溶液中进行k+s-5#u

C.产生的沉淀物属于复盐 D.产生的沉淀物一定是难溶物质
第Ⅱ卷(选择题,共55分)
14.科学家用NaNO3和Na2O在一定条件下化合制得由钠离子和阴离子B构成晶体NaxNO4,测定阴离子B中的各原子的最外层电子都达到了8电子稳定结构。下列说法错误的是
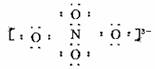 ( )
( )
A.x=3
B.N的化合价为+3
C. 阴离子B电子式可能为
D.此反应是非氧化还原反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com