
题目列表(包括答案和解析)
5、将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,称为燃料电池。下列叙述中正确的是
①通人CH4的电极为正极;
②正极的电极反应式为:O2 + 2H2O + 4e ==== 4OH-
③通人CH4的电极反应式为:CH4+ 2O2+ 4e ==== CO2 +2H2O
④负极的电极反应式为:CH4+ 10 OH-- 8e ===== CO32- + 7H2O
⑤放电时溶液中的阳离子向负极移动;
⑥放电时溶液中的阴离于向负极移动。
⑦工作时正极区pH升高,负极区pH降低
A.①③⑤⑦ B.②④⑥⑦ C. ②④⑤⑥ D.①②③④
4、近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和不锈钢为电极,以KI溶液(加少量K2CrO4)为电解液在一定条件下电解,反应方程式为KI+3H2O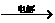 KIO3+3H2↑。下列有关说法正确的是
( )
KIO3+3H2↑。下列有关说法正确的是
( )
A 电解时,石墨作阴极,不锈钢作阳极
B 电解液调节至强酸性比较合适
C 电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D 电解中每转移0.6mol电子,理论上可得到21.4g无水KIO3晶体
3、将500 ml PH=5的硫酸铜溶液用惰性电极电解一段时间, 溶液PH变为2,若使溶液的浓度.PH与电解前相同,可采取的方法是
A 向溶液中加入0.245g Cu(OH)2 B 向溶液中加入0.31gCuCO3
C 向溶液中加入0.0025 molH2SO4 D 向溶液中加入0.2gCuO
2、用惰性电极电解某溶液时,发现两极只有H2和O2生成,则电解一段时间后,若电解前后温度变化忽略不计,下列有关溶液叙述正确的有
①该溶液的pH可能增大 ②该溶液的pH可能减小 ③该溶液的pH可能不变
④该溶液的浓度可能增大 ⑤该溶液的浓度可能不变
A.①②③④⑤ B.只有①②④⑤
C.只有①③⑤ D.只有②③④
1、 X、Y、Z、M代表四种金属元素.金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子.则这四种金属的活动性由强到弱的顺序为
A X>Z>Y>M B X>Y>Z>M C M>Z>X>Y D X>Z>M>Y
10.现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
⑴第一份加入AgNO3溶液有沉淀产生;
⑵第二份加过量NaOH溶液加热后,收集到气体0.02 mol ,同时得到溶液甲;
⑶在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,质量为1.02g;
⑷第三份加足量BaCl2溶液后,得白色沉淀,沉淀足量盐酸洗涤、干燥后,质量为11.65g。根据上述实验回答:
⑴肯定存在的离子是 。
⑵肯定不存在的离子是 。
⑶可能存在的离子是 。
⑷写出实验⑵所发生反应的离子方程式: 、 。
⑸确定溶液中的阳离子的物质的量浓度 。
9.现有A、B、C、D、E五种物质的水溶液,它们的溶质分别由SO42-、NO3-、Cl-、OH-、CO32-和Ba2+、Ag+、Fe3+、Na+、Al3+中的两种离子组成,且任何两种物质都不含有相同的离子。相关的实验如下:
①用pH试纸测定,只有A、E的溶液显碱性,且A、E的溶液pH均为11;
②将纯净铁粉加入到C溶液中,过滤后,称得溶液质量增加,溶液的颜色也有明显的变化;
 ③分别加BaCl2溶液于B和D的溶液中,只有D溶液中产生白色沉淀,该沉淀不溶于稀HNO3;
③分别加BaCl2溶液于B和D的溶液中,只有D溶液中产生白色沉淀,该沉淀不溶于稀HNO3;
⑴写出下列物质的化学式:B: C: D:
⑵通过上述实验还不确定A和E的组成,现只有蒸馏水、pH试纸、量筒等实验用品,请设计确定E组成的补充操作: 。
8.某无色溶液中可能性含有Na+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,依次进行下列实验。观察到现象如下:
①用pH试纸检验,溶液pH>7;
②向溶液中滴加氯水,无气体产生,再加入CCl4振荡、静置。CCl4层呈橙色,用分液漏斗分液;
③向分液后的水溶液中加入Ba(NO3)2和HNO3混合溶液;只有白色沉淀,过滤;
④在滤液中加入AgNO3和HNO3的混合液,有白色沉淀产生。回答下列问题
⑴原溶液中肯定含有的离子是 ;肯定没有的离子是 。
⑵步骤③所用Ba(NO3)2和HCl混合液,对判断①有无影响?
⑶写出步骤②中的离子方程式 。
7.有一透明溶液,已知其中可能含有Fe3+、NH4+、Al3+、Mg2+向该溶液中加入一种淡黄色粉末,并微热,产生有刺激性气味的混合气体,同时生成的白色沉淀,当加入0.4mol淡黄色粉末时,共收集到0.3 mol混合气体(假设所生成的气体全部逸出),且此时生成的沉淀量最多。再继续加入淡黄色粉末0.05 mol,沉淀由0.3 mol减小到0.2 mol,且再加粉末时,沉淀也不再减小。由实验现象和有关数据判断:
⑴淡黄色粉末是 。 ⑵原溶液中肯定没有的离子是 。
⑶原溶液中肯定有的离子是 ,其物质的量之比是 。
6.在一条鱼、虾绝迹的小河边有四座工厂;甲、乙、丙、丁(如图所示),它们排出的废液里,每
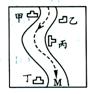 工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某中学环保
工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某中学环保
小组对河水监测时发现:①甲处河水呈乳白色 ②乙处河水呈红褐色
③丙处河水由浑浊变清 ④丁处产生气泡,河水仍然是澄清的。试推断:
⑴四座工厂排出的废液里含有的污染物:甲 乙
丙 丁 。
⑵甲、乙、丙、丁四座工厂排出的废液所电离出的离子,在M处取出的河水中,不能大量共存的离子是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com