

题目列表(包括答案和解析)
15、下图为相互串联的甲、乙两电解池试回答:
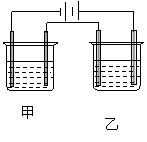
(1)若甲池利用电解原理在铁上镀银,则A是 、 (填电极材料和电极名称),电极反应是 ;B(要求同A)是 、 ,电极反应式是 400mLNaCl ,应选用的电解质溶液是 。
(2)乙池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色,C极附近呈 色。
(3)若甲槽阴极增重43.2g,则乙槽中阳极上放出的气体在标况下的体积是 _____mL。
(4)若乙槽中剩余溶液仍为400mL,则电解后所得溶液的物质的量浓度为mol/L,pH值等于 。
14、氯碱厂电解饱和食盐水制取NaOH的工艺流程如下图:

完成下列填空:
(1)在电解过程中,与电源正极相连的电极上的电极反应式为 。与电源负极相连的电极附近溶液pH (填“不变”“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 、 。
(3)如果粗盐中SO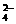 含量较高,必须添加钡试剂除去SO
含量较高,必须添加钡试剂除去SO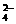 ,该钡试剂可以是 (选填“A”“B”“C”,多选扣分)。
,该钡试剂可以是 (选填“A”“B”“C”,多选扣分)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)为有效除去Ca2+、Mg2+、SO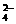 ,加入试剂的合理顺序为
(选填“A”“B”“C”,多选扣分)
,加入试剂的合理顺序为
(选填“A”“B”“C”,多选扣分)
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,无隔膜电解食盐水的总的化学方程式为 。
13、由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用下图电解实验可以制得白色纯净的Fe(OH)2沉淀。两电极材料分别为石墨和铁。

(1)a电极材料应为 ,
电极反应式为 。
(2)电解液c可以是 。(填编号)
A.纯水 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是 ,在加入苯之前对c应作何简单处理 。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号) 。
A.改用稀硫酸做电解液
B.适当增大电源的电压
C.适当减小两电极间距离
D.适当降低电解液的温度
(5)若c中用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为 。
12、通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若
被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)∶n(硝酸亚汞)=2∶1,则下列表
述正确的是: ( )
A.在两个阴极上得到的银和汞的物质的量之比为1∶1
B. 在两个阳极上得到的产物的物质的量不相等
C. 硝酸亚汞的分子式为HgNO3
D. 硝酸亚汞的分子式为Hg2(NO3)2
11、.用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为
A.1 mol·L-1 B.2 mol·L-1
C.3 mol·L-1 D.4 mol·L-1
10、.甲、乙两个电解池均以Pt为电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池中电极质量增加2.16 g,乙池中电极上析出0.64 g金属,则乙池中溶质可能是
A.CuSO 4 B.MgSO4 C.Al(NO3)3 D.Na2SO4
9、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
( )
A.放电时负极反应为:Zn-2e-+2OH- =Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH- =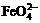 +4H2O
+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
8、关于电解NaCl 水溶液,下列叙述正确的是 ( )
A、电解时在阳极得到氯气,在阴极得到金属钠
B、若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C、若在阴极附近的溶液中滴入酚酞试液,溶液呈棕色
D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后,溶液呈中性
7、氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍
电池。氢镍电池的总反应式是 (1/2)H2+NiO(OH) 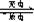 Ni(OH)2。根据此反应式判断,下列叙述中正确的是 ( )
A、电池放电时,电池负极周围溶液的pH不断增大
Ni(OH)2。根据此反应式判断,下列叙述中正确的是 ( )
A、电池放电时,电池负极周围溶液的pH不断增大
B、电池放电时,镍元素被氧化
C、电池充电时,氢元素被还原
D、电池放电时,H2是负极
6、下列四种装置中,溶液的体积均为250毫升,开始时电解质溶液的浓度均为0.10摩/升,工作一段时间后,测得导线上均通过0.02摩电子,若不考虑溶液体积的变化,则下列叙述正确的是 ( )

A 工作一段时间后溶液的浓度①=②=③=④
B 工作一段时间后溶液的pH值:④>③>①>②
C 产生气体的总体积:④>③>①>②
D 电极上析出的固体的质量:①>②>③>④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com