
题目列表(包括答案和解析)
19.(8分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
|
红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应____________________________________;
化合反应____________________________________。
(2)化学实验中预料之外的现象往往包含我们还没有认识的事物规律。下面是该实验小组进行“铝和氯化铜溶液反应”实验时观察到的预料之外的现象研究:
①铝丝表面附上的铜没有紧密吸附在铝丝的表面而是呈蓬松的海绵状;②反应一段时间后有大量气泡逸出,且在一段时间内气泡越来越快,经点燃能发出爆鸣声,证明是氢气。
“科学研究还离不开合理的猜想和假设。”该同学先从理论上猜想铝丝表面产生氢气的多种可能原因,再设计实验验证自己的猜想。
实验操作及现象记录:
取4根去油去锈的铝丝为A组直接和下列溶液反应,4根下半截缠上细铜丝的铝丝为B组和下列溶液反应,再取前面实验中得到的附有海绵状铜的4根铝丝洗净后作为C组和下列溶液反应作比较,实验现象记录如下:
|
|
热水 |
硫酸铜溶液(2.0mol/L) |
氯化铝热溶液(2.0mol/L) |
饱和氯化钠 热溶液 |
|
A |
只在开始时 有少量气泡 |
气泡较多,但比同浓度的氯化铜溶液少 |
有气泡, 比热水多 |
气泡比热水稍多,但比氯化铝溶液少 |
|
B |
气泡比相应A多 |
气泡比相应A多 |
气泡比相应A多 |
气泡比相应A多 |
|
C |
气泡比相应B多 |
气泡比相应B多 |
气泡比相应B多 |
气泡比相应B多 |
实验现象说明氢气的生成原因是多种因素作用的结果。试推测该同学原来的猜想有哪些(不一定填满,不够也可以自己添加):
①反应生成的铜和铝组成原电池促进铝和水反应;
② ;
③ ;
④ ;
18. (10分) A、B是下列浓度均为0.1mol/L的溶液中的某一种:①混有少量盐酸的MgSO4溶液,②A12(SO4)3溶液,③明矾溶液,④Ba(OH)2溶液,⑤NaOH溶液。现向溶液A中逐滴加入溶液B,用得到的沉淀质量与所加B溶液的体积的关系大致可画如右图像(未画完整,而且“大致”的意思是只需保证从一开始就有沉淀,最后沉淀的量为一定值即可,不必拘泥于斜率的大小)。
(10分) A、B是下列浓度均为0.1mol/L的溶液中的某一种:①混有少量盐酸的MgSO4溶液,②A12(SO4)3溶液,③明矾溶液,④Ba(OH)2溶液,⑤NaOH溶液。现向溶液A中逐滴加入溶液B,用得到的沉淀质量与所加B溶液的体积的关系大致可画如右图像(未画完整,而且“大致”的意思是只需保证从一开始就有沉淀,最后沉淀的量为一定值即可,不必拘泥于斜率的大小)。
(1)符合这一图像的组合有多组,如表中的①和④,请你将其他所有可能的组合填入下表中(已填了两组,不一定填满,如果空格不够还可自行补充)。
|
A |
① |
④ |
|
|
|
|
|
|
|
B |
④ |
① |
|
|
|
|
|
|
 (2)若向试剂④中逐渐加入试剂①,请画出生成的沉淀质量(y)与所加溶液体积(x)的关系曲线示意图。
(2)若向试剂④中逐渐加入试剂①,请画出生成的沉淀质量(y)与所加溶液体积(x)的关系曲线示意图。
17.(12分)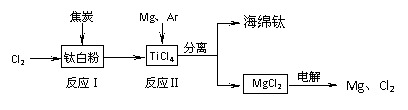 21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
已知:
① Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
 (1)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子方程式为 。
(1)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子方程式为 。
(2)反应Ⅰ在800-900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为 ;反应Ⅱ的热化学方程式为 。
(3)该工艺流程中,可以循环使用的物质有 。
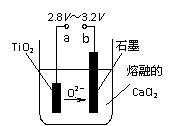
(4)在800℃-1000℃时电解TiO2也可制得海绵钛,装置如右图所示。图中b是电源的 极,阴极的电极反应式为 。
16.(13分)短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为nsnnpn+1,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是
(填元素符号或化学式,下同);第一电离能从大到小的顺序是
(2)由A、C两种元素形成的离子化合物中C元素的质量分数为73.68%,它的所有原子最外层都符合相应的稀有气体原子的最外层电子层结构,该物质加热时就能分解为两种气体,则X的化学式为 ,X受热分解的化学方程式为_____________________ 。
(3)C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质。则Y的化学式为 ,Y的阴离子是一种弱酸根离子,全由C元素组成,与Y的阴离子具有相同原子数和电子数的分子有 (任写一种),Y与盐酸反应的离子方程式为 。
15.某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法不正确的是( )
A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中可能含有Fe3+
C.若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
第Ⅱ卷(非选择题 共55分)
14.在含有氯化铁、氯化亚铁、氯化铝、氯化钠的混合溶液中加入足量的过氧化钠固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是( )
A.Al3+ B.Na+ C.Fe3+ D.Fe2+
13.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O=6Cu+SO2下,关于该反应的说法中,正确的是
A.该反应的氧化剂只有Cu2O
B.Cu2S在反应中既是氧化剂,又是还原剂
C.Cu既是氧化产物又是还原产物
D.每生成19.2gCu,反应中转移1.8mol电子
12.向某无色溶液中逐滴加入稀氨水,开始产生沉淀,继续滴加,沉淀逐渐消失,仍得无色溶液,则原溶液可能是
A. AlCl3 B. FeCl3 C. BaCl2 D. AgNO3
11.一定能在下列溶液中大量共存的离子组是
A.水电离产生的c(OH-)=1×10-12mol·L”的溶液中:NH4+、Na+、C1-、HCO3-
B.能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32-
C.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D.澄清透明的无色溶液中:ClO-、MnO4-、Al3+、SO42-
10.等体积、等物质的量浓度的稀硫酸,氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
A、甲、乙中都是铝过量 B、甲中酸过量,乙中碱过量
C、甲中酸过量,乙中铝过量 D、甲中铝过量,乙中碱过量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com