
题目列表(包括答案和解析)
1.有关晶体的下列说法中正确的是 ( )
A.氧化镁熔化时离子键未被破坏
B.原子晶体中共价键越强,熔点越高k+s-5#u

C.分子晶体中分子间作用力越大,分子越稳定
D.冰熔化时水分子中共价键发生断裂冰熔化时水分子间的氢键被破坏。
23.某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是________________________________。
(2)方案二:按下图装置进行实验。并回答以下问题:
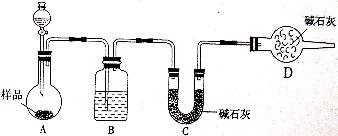
①实验前应先________________。分液漏斗中应该装___________(填“盐酸”或“稀硫酸盐”)。D装置的作用是_________________________________________;
②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化;
③根据此实验得到的数据,测定结果有较大误差。因为实验装置还存在一个明显缺陷,该缺陷是_______________________________________________________。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有______________________;
②试验中判断沉淀是否完全的方法是_______________________________________
____________________________________________________________________;
③若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为_________________(保留一位小数)。
22.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
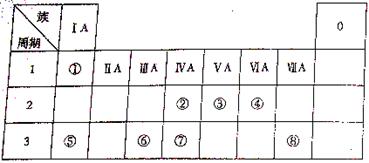
(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示)________________。
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示)
__________________________________________________________________。
(2)写出由以上某些元素构成的既含离子键、又含极性共价键的化合物的电子式(写出一种即可)_______________________。
(3)已知常温下1g ①单质在④单质中燃烧生成稳定的液态物质时放出142.9kJ热量,则表示①单质燃烧热的热化学方程式为___________________________________。
(4)①②形成的最简单的化合物与④单质在KOH作电解液时可形成原电池,其中负极的电极反应为__________________________________________________________。
(5)由表中元素①③④⑥⑧所形成的常见物质X、Y、Z、M、N可发生以下反应:
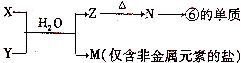
①X溶液与Y溶液反应的离子方程式为_________________________________;
②N→⑥的单质所采用的方法是____________________________;
③M溶液呈酸性,原因是(用离子方程式解释)
_________________________________________________________________。
21.醋酸是重要的一元酸,在有机和无机反应中都有应用。
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表:
|
反应 |
乙醇(mol) |
乙酸(mol) |
乙酯乙酯(mol) |
|
1 |
2 |
2 |
1.33 |
|
2 |
3 |
2 |
1.57 |
|
3 |
4 |
2 |
x |
|
4 |
5 |
2 |
1.76 |
由表中数据推测,数值 的范围是_____________________________。
的范围是_____________________________。
(2)现有25℃时,pH=3的醋酸。请回答以下问题:
①若向醋酸中加入少量醋酸钠固体,此时溶液中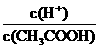 将_________(填“增大”、“减小”或“不变”)
将_________(填“增大”、“减小”或“不变”)
②若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH_______7(填“ ”、“
”、“ ”或“=”);
”或“=”);
③若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是:
____________________________________________________________________。
20.300℃时,将2molA和2molB两种气体混合于2L密闭容器中,发生如下发应: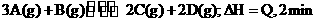 末达到平衡,生成0.8mol D。
末达到平衡,生成0.8mol D。
(1)300℃时,该反应的平衡常数表达式为:K=_________________________。
已知K300℃<K350℃,则 ____________0(填“
____________0(填“ ”或“
”或“ ”)。
”)。
(2)在2min末时,B的平衡浓度为___________,D的平均反应速率为___________。
(3)若温度不变,缩小容器容积,则A的转化率__________(填“增大”、“减小”或“不变”),原因是________________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时若加入C、D各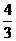 mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还原该加入B_________mol。
mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还原该加入B_________mol。
19.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中,H2O2只发生如下过程:H2O2-→O2。
(1)该反应的还原剂是_____________。
(2)若反应转移了0.3mol电子,则产生的气体在标准状况下的体积是________L。
(3)写出该反应的化学方程式___________________________________________。
18.元素X的单质及X与Y形成的化合物能按下图所示的关系发生转化:
 下列说法不正确的是
下列说法不正确的是
A.X可能是金属
B.X可能是非金属
C.n可以等于2或3
D.XYm与XYn的相互转化是可逆反应
第II卷(非选择题,共46分)
非选择题(本题包括5小题,共46分)
17.某溶液中大量存在五种离子: 、
、 、
、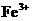 、
、 、
、 (M代表一种离子),其物质的量之比为
(M代表一种离子),其物质的量之比为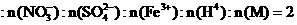 :3:1:3:1,则M可能为
:3:1:3:1,则M可能为
A.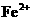 B.
B.
C.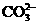 D.
D.
16.关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不小时,可能确定有Cl-存在
B.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I一存在
C.加入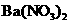 溶液,生成白色沉淀,加稀盐酸沉淀不小时,可确定有
溶液,生成白色沉淀,加稀盐酸沉淀不小时,可确定有 存在
存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有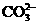 存在
存在
15.将pH=3的盐酸a L 分别与下列三种溶液混合后,混合液均呈中性;
① 的氨水
的氨水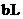
②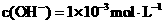 的氨水
的氨水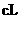
③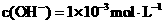 的
的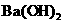 的溶液
的溶液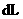
其中a、b、c、d的关系正确的是
A.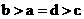 B.
B.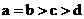
C.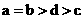 D.
D.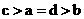
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com